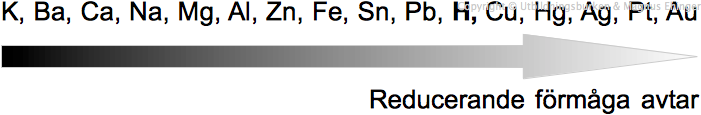Tillåtna hjälpmedel är penna, suddgummi, linjal, miniräknare och formelsamling. Samtliga svar skall skrivas på detta pappret.
Till vissa frågor behöver du Tabell 1 eller den elektrokemiska spänningsserien längst bak i skrivningen. Till andra frågor finner du de uppgifter du behöver i tabellsamlingen.
Del I. Endast lösning (svar) krävs. Glöm inte enhet!
- Ange för följande reaktioner om de är exo- eller endoterma! (5x0,5p)
- Framställning av CO(g) ur grundämnena
- Sönderdelning av NO2(g) i grundämnena
- Sönderdelning av Al2O3(s) i grundämnena
- Sönderdelning av butan, C4H10 i grundämnena
- Förbränning av socker, C12H22O11
- Hur stor blir entalpiändringen i kJ för reaktionen
H2(g) + Cl2(g) → 2HCl(g)? (1p)
- Hur stor blir \(\Delta H\) (i kJ) för reaktionen
Na+(g) + Cl–(g) → NaCl(s)
när följande reaktioner är givna (1p):
Na(g) + Cl(g) → Na+(g) + Cl–(g); \(\Delta H_1 = +147k\mathrm{J}\)
Na(s) + ½Cl2(g) → Na(g) + Cl(g); \(\Delta H_2 = +230k\mathrm{J}\)
Na(s) + ½Cl2(g) → NaCl(s); \(\Delta H_3 = -411k\mathrm{J}\)
- -34 kJ
- +34 kJ
- +328 kJ
- +494 kJ
- -788 kJ
- Ange vilken metall som blir positiv pol i en galvanisk cell där polerna består av... (2x0,5p)
- Bly och järn
- Tenn och zink
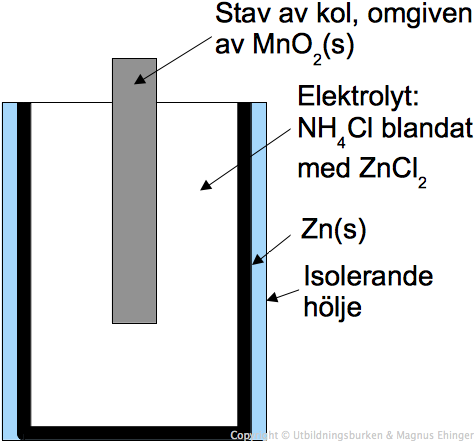
- I salmiakelementet (se figuren nedan) oxideras zink till zinkjoner medan brunsten, MnO2, reduceras till MnOOH. Elektrolyten består av en blandning av salmiak, NH4Cl, och zinkklorid, ZnCl2.
Två av följande påståenden är felaktiga. Ange vilka! (2p)
- Zinkjonkoncentrationen minskar intill den negativa polen
- Lösningen blir surare runt den positiva polen
- Kol deltar inte i reaktionen
- Ammoniumjoner fungerar i elementet som syra
- Zink är negativ pol
- I en viss galvanisk cell, en s.k. bränslecell, består minuspolen av vätgas, H2(g), och pluspolen av syrgas, O2(g). Elektrolyten som sammanbinder dem består av kaliumhydroxid, KOH. Vilket av följande påståenden om bränslecellen är felaktigt? (1p)
- Vid pluspolen reduceras syre
- Vid minuspolen utvecklas vätgas
- Elektrolytens koncentration minskar när cellen arbetar.
- Totalförloppet motsvarar bildning av vatten ur grundämnena
- I cellen omvandlas kemisk energi till elektrisk energi
Del II. Fullständig lösning och (i förekommande fall) balanserade reaktionsformler krävs. Glöm inte enhet!
- Kalciummetall får i ett experiment reagera med 1 mol syrgas. Skriv reaktionsformel, och ange med kort motivering troligt tecken på ΔH på reaktionen! (2p)
- Hur stor värmemängd utvecklas då 1,00 g magnesium förbränns till magnesiumoxid? (3p)
- En galvanisk cell består av ett zinkbleck i en zinknitratlösning och ett silverbleck i silvernitratlösning, förbundna med varandra på ett lämpligt sätt. Skriv cellschema, reaktion vid plus- och minuspolen, samt cellreaktion för cellen (4p)!
- Hur stor energimängd krävs för att vid standardtillståndet framställa 1,00 dm3 O2(g) ur H2O(l)? Gasmolvolymen kan antas vara 24,0 dm3/mol. (4p)
- Du värmer 1,00 kg vatten genom att förbränna 10,0 g butan. Temperaturen på vattnet stiger från 23,6°C till 98,2°C. Hur stor andel (i %) av värmet från förbränningen av butan överförs till vattnet? Förbränningsentalpin för butan är -2877 kJ/(mol·K). (4p)
Tabell 1. Bildningsentalpier vid standardtillståndet, 25°C och 1,013·105 Pa
|
Ämne |
ΔH (kJ/mol) |
|
CaO(s) |
-635 |
|
MgO(s) |
-601 |
|
Fe2O3(s) |
-822 |
|
Al2O3(s) |
-1670 |
|
CuO(s) |
-155 |
|
HgO(s) |
-91 |
|
Ag2O(s) |
-30 |
|
Au2O3(s) |
-3,3 |
|
CO(g) |
-110 |
|
CO2(g) |
-394 |
|
N2O(g) |
+82 |
|
NO(g) |
+90 |
|
NO2(g) |
+34 |
|
H2O(l) |
-286 |
|
H2O(g) |
-242 |
|
H2S(g) |
-20 |
|
NH3(g) |
-46 |
|
CH4(g) |
-75 |
|
C3H8(g) |
-104 |
|
HCl(g) |
-92 |
|
HBr(g) |
-36 |
|
HI(g) |
+26 |