![]() Den här artikeln bygger på en hemsida jag ramlade över för många år sedan på http://www.santesson.com/julkemi/chemhome.htm. Tyvärr finns den inte kvar längre, men lyckligtvis hittade jag den sparade informationen! (Jag gör alltså inga som helst anspråk på att själv ha författat texten nedan. Men jag tyckte den var såpass intressant, att jag tar mig friheten att kopiera den. Jag har också uppdaterat länkarna, lagt till bilder och video samt rättat en del tryckfel.)
Den här artikeln bygger på en hemsida jag ramlade över för många år sedan på http://www.santesson.com/julkemi/chemhome.htm. Tyvärr finns den inte kvar längre, men lyckligtvis hittade jag den sparade informationen! (Jag gör alltså inga som helst anspråk på att själv ha författat texten nedan. Men jag tyckte den var såpass intressant, att jag tar mig friheten att kopiera den. Jag har också uppdaterat länkarna, lagt till bilder och video samt rättat en del tryckfel.)
De ursprungliga sidorna, i sin tur, bygger på ett litet häfte som FOA ABC-skydd sände ut som julhälsning 1986. En del av materialet har tagits med i oförändrad form medan annat har uteslutits eller helt skrivits om.
De svenska jultraditionerna
 Jenny Nyström (tomte). De svenska jultraditionerna består av en underbar blandning av gamla hedniska riter, som har sitt ursprung från vikingatiden, och kristna seder som införts på ett senare stadium. Många av traditionerna är från kemisk synpunkt riktigt fascinerande och intressanta.
Jenny Nyström (tomte). De svenska jultraditionerna består av en underbar blandning av gamla hedniska riter, som har sitt ursprung från vikingatiden, och kristna seder som införts på ett senare stadium. Många av traditionerna är från kemisk synpunkt riktigt fascinerande och intressanta.
Julkryddorna
Man skulle kunna säga att det svenska julfirandet börjar på Luciadagen den 13 december. I katolska länder firas Lucia till åminnelse av det sicilianska helgonet men i Sverige var anledningen ursprungligen att det var årets kortaste dag (innan den gregorianska kalendern infördes 1753). De moderna svenska Lucia-traditionerna går bara tillbaka till 1920-talet. Till dem hör att servera ett sött vetebröd kryddat med saffran, den första av julkryddorna.
 Saffranskrokus, Crocus sativus. Saffran består av pistillerna från saffranskrokusen Crocus sativus. Den gula färgen beror på närvaron av den karotenoida föreningen crocin:
Saffranskrokus, Crocus sativus. Saffran består av pistillerna från saffranskrokusen Crocus sativus. Den gula färgen beror på närvaron av den karotenoida föreningen crocin:
Tidigare användes saffran inte bara som en krydda, utan även som textilfärg. Smaken på saffran härrör från aromatiska oljor och den bittra glykosiden pikrocrocin.
Saffran är ganska giftigt – några gram kan vara dödande – och har använts vid försök att framkalla aborter. Det gula crocinet tas snabbt upp i kroppen och förlänar offren ett gulsotsliknande utseende. Om man tar saffran i förväg skall det enligt Plinius motverka effekterna av alkohol. Kanske är det därför det är så populärt vid Lucia-firandet, vilket ju brukar innefatta konsumtion av stora mängder glögg.
 Ingefära. Under veckan före jul är det för många svenska familjer dags att ge sig in i byggbranschen och bygga sina egna pepparkakshus - och därmed använda sig av ytterligare två julkryddor, ingefära och kanel. Ingefärans genomträngande smak kommer från en serie så kallade gingeroler, fenoliska ketoner av den här typen:
Ingefära. Under veckan före jul är det för många svenska familjer dags att ge sig in i byggbranschen och bygga sina egna pepparkakshus - och därmed använda sig av ytterligare två julkryddor, ingefära och kanel. Ingefärans genomträngande smak kommer från en serie så kallade gingeroler, fenoliska ketoner av den här typen:
Kanelen får sin arom från kanelaldehyd, (E)-3-fenyl-2-propenal, som lätt kan syntetiseras genom kondensation av bensaldehyd and acetaldehyd.
Ett pepparkakshus dekoreras vanligen med kristyr, en vit blandning av pudersocker, äggvita och några droppar citronsaft eller vinäger. Syran är en viktig beståndsdel eftersom det är den som får äggvitan att koagulera och därmed hela blandningen att stelna.
Julaftonen är höjdpunkten på det svenska julfirandet med kulinariska attraktioner som lutfisk, köttbullar, revbensspjäll, sill i olika former, syltor, osv. Den gastronomiska höjdpunkten är julskinkan, vanligen ugnsbakad och med en panering av senap, äggula och ströbröd, serverad tillsammans med massor av senap.
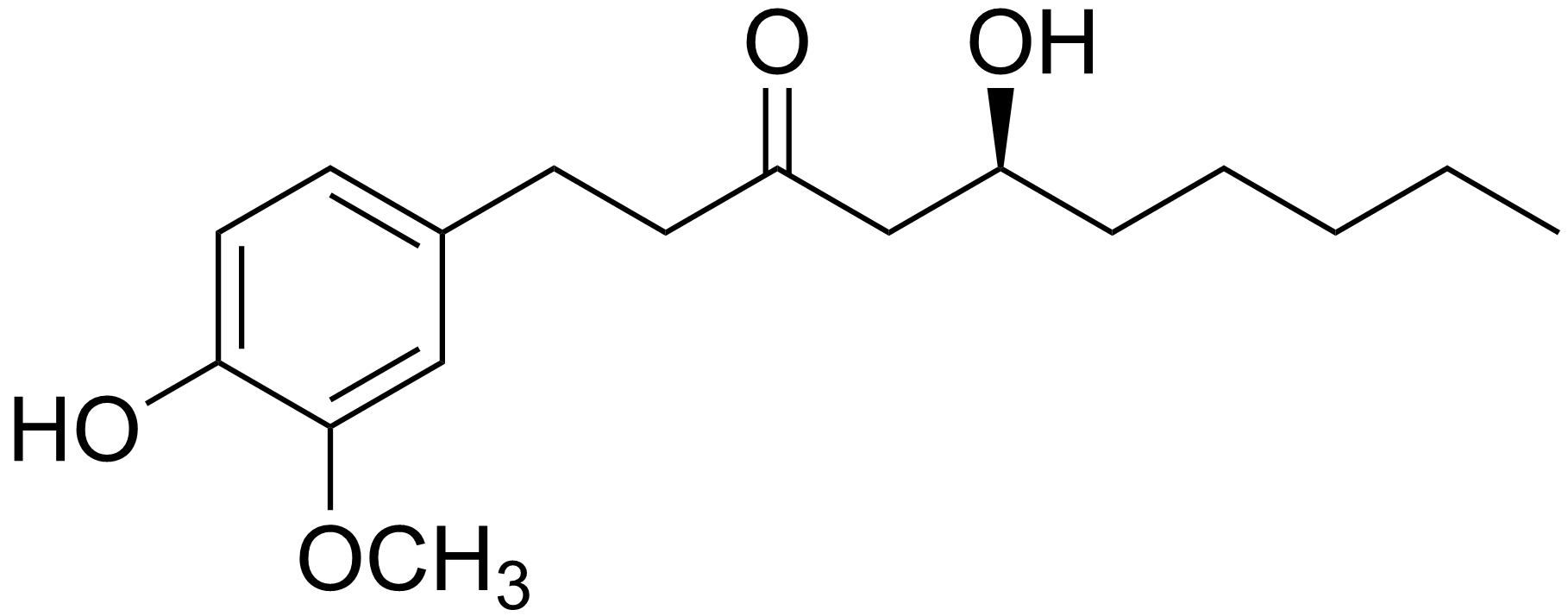
Senapens smak och lukt kommer främst från en grupp föreningar som kallas isotiocyanater. Prekursorer, d.v.s. utgångsmaterial till dessa ämnen finns i senapskornen i form av glukosinolater, t.ex. sinigrin.
Dessa utgångsämnen är smak- och luktlösa, men i närvaro av vatten kan de hydrolyseras med hjälp av ett enzym till glykos, kaliumbisulfat och isotiocyanater, t.ex. allyl-isotiocyanat,  . Den sistnämnda föreningen är en måttligt flyktig vätska med en genomträngande, irriterande lukt och besk smak.
. Den sistnämnda föreningen är en måttligt flyktig vätska med en genomträngande, irriterande lukt och besk smak.
Den är inte speciellt giftig (oral LD50 omkring 300 mg per kilogram kroppsvikt), men är en snabbverkande irritant på hud och slemhinnor. Under första världskriget försökte man använda allyl-isotiocyanat som ett prestationsnedsättande kemiskt stridsmedel, men utan framgång.
Förväxla inte allyl-isotiocyanat med senapsgas, som är något helt annat. Senapsgasen har fått sitt namn efter vissa senapsluktande föroreningar som bildas vid senapsgastillverkning enligt en viss metod.
För att erhålla allyl-isotiocyanat är det inte nödvändigt att isolera ämnet från senapskorn. Det kan lätt syntetiseras från allyljodid och kaliumtiocyanat.
Enligt Linné är senap ett potent afrodisiakum, vilket skulle kunna förklara den omfattande användningen under det svenska julfirandet. Trots allt var detta firande från början rena fruktbarhetsriter!
 Kryddnejlika. En annan av de viktigaste julkryddorna är kryddnejlika, de torkade blomknopparna av Eugenia caryophyllata. De används ofta för att dekorera och smaksätta skinka, som en extra krydda i pepparkakor och som en viktig ingrediens i glögg. Smaken kommer från en flyktig olja, nejlikolja, med eugenol (4-allyl-2-metoxyfenol) som huvudingrediens. Eugenol är milt bedövande, och nejlikolja användes förr mot tandvärk, i synnerhet i form av en blandning med zinkoxid. Nejlikolja är också en effektiv attraktant för insekter och möjligen även män, eftersom den ibland används i parfymer.
Kryddnejlika. En annan av de viktigaste julkryddorna är kryddnejlika, de torkade blomknopparna av Eugenia caryophyllata. De används ofta för att dekorera och smaksätta skinka, som en extra krydda i pepparkakor och som en viktig ingrediens i glögg. Smaken kommer från en flyktig olja, nejlikolja, med eugenol (4-allyl-2-metoxyfenol) som huvudingrediens. Eugenol är milt bedövande, och nejlikolja användes förr mot tandvärk, i synnerhet i form av en blandning med zinkoxid. Nejlikolja är också en effektiv attraktant för insekter och möjligen även män, eftersom den ibland används i parfymer.
Lutfisk – en kulinarisk katastrof
En av de mera anmärkningsvärda svenska julrätterna är lutfisk, vilken beskrivs i Webster's New International Dictionary på följande sätt:
Lut'fisk, n. (Nor. & Sw. prop., lyed fish), stockfish which has been soaked for several days in lye water to prepare it for cooking."
Få icke-skandinaver har konfronterats med rätten, men en har beskrivit erfarenheten på ett föga uppskattande (men humoristiskt) sätt.
För att bereda lutfisk måste man ta till ganska så aggressiva kemikalier:
Tag ett kilo klippfisk (torkad fisk, helst beredd på torsk, långa eller likartad torsksläkting, fångad tidigt på sommaren) och dela varje fisk i tre delar. Lägg bitarna i en träbalja, täck dem med vatten och låt dem ligga i blöt en vecka. Vattnet måste bytas dagligen. Tag upp bitarna, rengör träbaljan och täck botten med 100-150 gram släckt kalk. Bered en lut av 150 gram kristallsoda (OBS! tag ej "kaustik soda", d.v.s. natriumhydroxid) och tillräckligt med vatten för att täcka fiskbitarna. I stället för soda kan 1 kilo björkaska användas.
Häll luten över fiskbitarna. När de så småningom sväller tillsätts mer vatten så att de hela tiden är täckta.
Efter omkring en vecka är bitarna så mjuka att man lätt kan köra ett finger genom dem. Tag upp dem och skölj av dem, tvätta ur träkaret, lägg tillbaka fiskbitarna och täck dem med rent vatten. Låt dem ligga i blöt under två veckor. Under den första veckan skall vattnet bytas dagligen.
Smält smör i en kastrull och lägg i de avsköljda fiskbitarna, lägg på ett lock och låt dem bräsera på svag värme under 15-20 minuter. Lutfisken är nu färdig att serveras, helst tillsammans med skirat smör, senap och kryddpeppar. Om man så vill kan en särskild senapssås beredas."
 Lutfisk. Den viktigaste effekten av behandlingen med alkali är att vävnaderna blir mjukare genom att protein löses ut. Det ursprungliga kilot av torkad fisk innehåller omkring 750 gram protein. Under behandlingen ökar totalvikten till sex kilo genom vattenupptag, men bara hälften av proteinet (350-400 gram) återstår.
Lutfisk. Den viktigaste effekten av behandlingen med alkali är att vävnaderna blir mjukare genom att protein löses ut. Det ursprungliga kilot av torkad fisk innehåller omkring 750 gram protein. Under behandlingen ökar totalvikten till sex kilo genom vattenupptag, men bara hälften av proteinet (350-400 gram) återstår.
pH hos den behandlade, vattenuppsvällda lutfisken är omkring 11. Under den sista uppvärmningen stiger pH till 12, antagligen genom att fasta kalkpartiklar går i lösning i vävnaderna vid den förhöjda temperaturen. Lutfisk är sålunda den mest alkaliska rätt som är känd.
Behandlingen med alkali ger upphov till bildning av nya föreningar, t.ex. lysinoalanin (LAL), HOOC-CH(NH2)-(CH2)4-NH-CH2-CH(NH2)-COOH. Råttor är speciellt känsliga för LAL. Får de 250 ppm LAL i födan under en veckas tid kan resultatet bli en typ av reversibel njurskada som kallas nefrocytomegali. Eftersom lutfisk kan innehålla upp till 300 ppm LAL är det en klart olämplig diet för råttor.
Men hav förtröstan! En "Right to Know"-förordning från Wisconsin, U.S.A., innehåller följande definition:
'Toxic substance' means any substance or mixture containing a substance regulated by the federal Occupational Safety & Health Administration under Title 29 of the Code of Federal Regulations, Part 1910, Subpart z, which is introduced by an employer to be used, studied or produced in the workplace. 'Toxic substance' does not mean lutefish."
Julens kålsorter
Kålväxterna är ovanligt köldtåliga och därmed nästan de enda svenska grönsaker som kan fås färska även i december. Detta är antagligen den viktigaste förklaringen till deras centrala roll på det svenska julbordet med brysselkål, rödkål, långkål och brunkål att äta till julskinkan och kruskål som ätbar dekoration.
Ur kemisk synpunkt är brysselkålen nog intressantast. Det är en förhållandevis ung kålsort, de första omnämnandena kommer från Belgien i slutet på 1500-talet och under 1700-talet började brysselkål odlas i Sverige. Den är mycket rik på C-vitamin - redan 50 gram brysselkål ger hela dagsbehovet - och även på folsyra (en sorts B-vitamin).
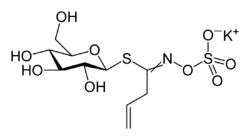 Sinigrin. Korsblommiga växter innehåller ofta en grupp ämnen som kallas för glucosinolater, och brysselkålen är inget undantag: den innehåller sinigrin, som är ett glukosinolat. Detta ämne är i sig rätt oskyldigt, men sönderdelas snabbt av ett enzym, kallat myrosinas, till sulfatjon, glukos och allylisotiocyanat. Enzymet finns på plats i brysselkålen och frisätts och kan börja verka så snart vävnaderna på något sätt skadas.
Sinigrin. Korsblommiga växter innehåller ofta en grupp ämnen som kallas för glucosinolater, och brysselkålen är inget undantag: den innehåller sinigrin, som är ett glukosinolat. Detta ämne är i sig rätt oskyldigt, men sönderdelas snabbt av ett enzym, kallat myrosinas, till sulfatjon, glukos och allylisotiocyanat. Enzymet finns på plats i brysselkålen och frisätts och kan börja verka så snart vävnaderna på något sätt skadas.

Försök vid Institute of Food Research i Norwich, England, har nyligen visat att om råttor med förstadium till cancerceller i mag-tarm-kanalen ges allylisotiocyanat så stoppas tillväxten av dessa celler och de dör ut. Det återstår att se om verkan är densamma på människa.
Ges en människa stora doser kan svåra verkningar uppträda. På huden ger ämnet upphov till blåsbildning på ungefär samma sätt som senapsgas. Vid inandning får man i stället lungödem och vid förtäring allvarliga njurskador. Allylisotiocyanat har f.ö. även använts för att försöka framkalla aborter.
Samtidigt är det detta ämne som ger brysselkålen dess karaktäristiska milt beska smak. Hur man uppfattar smaken är beroende av ärftliga faktorer. En fjärdedel av alla människor är "supertasters" och finner smaken mycket kraftigt besk medan en fjärdedel är "nontasters" och känner bara en svag smak. Kanske ligger här en del av förklaringen till att många barn ogillar brysselkål.
 Indol-3-carbinol. Brysselkål innehåller också ett annat intressant ämne, nämligen indol-3-karbinol. Det finns en form av vårtor som uppträder i luft- och matstrupen, inte minst hos barn. Oftast är dessa vårtor ofarliga, men de kan i vissa fall snabbt utvecklas till maligna tumörer. Ett alternativ till att avlägsna vårtorna kirurgiskt är att behandla dem med indol-3-karbinol, som ofta får dem att försvinna.
Indol-3-carbinol. Brysselkål innehåller också ett annat intressant ämne, nämligen indol-3-karbinol. Det finns en form av vårtor som uppträder i luft- och matstrupen, inte minst hos barn. Oftast är dessa vårtor ofarliga, men de kan i vissa fall snabbt utvecklas till maligna tumörer. Ett alternativ till att avlägsna vårtorna kirurgiskt är att behandla dem med indol-3-karbinol, som ofta får dem att försvinna.
Rödkålen får sin vackra färg från antocyaniner, föreningar som består av socker och fenoliska färgämnen som kallas antocyanidiner.  Glöggkryddad rödkål. På samma sätt som lackmuspapper är färgen beroende av surhetsgraden eller pH. Man brukar tillaga rödkål tillsammans med vinäger, citron eller sura äpplen för att säkerställa att det förblir surt och därmed att den röda färgen bevaras. Om man i stället sätter till en bas, t.ex. bikarbonat, övergår rödkålen i blåkål!
Glöggkryddad rödkål. På samma sätt som lackmuspapper är färgen beroende av surhetsgraden eller pH. Man brukar tillaga rödkål tillsammans med vinäger, citron eller sura äpplen för att säkerställa att det förblir surt och därmed att den röda färgen bevaras. Om man i stället sätter till en bas, t.ex. bikarbonat, övergår rödkålen i blåkål!
Långkål och brunkål är inga egna kålsorter utan sätt att tillaga kål. Långkål, en halländsk rätt, görs av grönkål som steks i skinkfett och sedan späds med grädde. Den skånska specialiteten brunkål bereds av vitkål som bryns med skinkfett och sirap, varefter den fuktas med skinkspad och får puttra i ugn. Vid bryningen karamelliseras sockret i sirapen. Detta innebär att de små sockermolekylerna övergår i högmolekylära, bruna polymerer, samtidigt som en del aromämnen bildas. Det är samma process som ligger till grund för t.ex. knäckkokningen inför jul.
Julgranen – en kemisk fabrik
Författare: Per Olof Granbom
Julgranen är inte en ursprunglig svensk jultradition, utan en sedvänja som importerades från Tyskland i mitten på 1700-talet. Från början var det endast överklassen som använde julgranar, men omkring sekelskiftet 1900 hade sedvänjan spritt sig till bönder och arbetarklass.
 En kemisk fabrik. Förutsättningarna för denna tradition är mycket goda eftersom gran, i regel arten Picea abies, är allmän över hela landet med undantag för de sydligaste delarna. Gran är också en av de viktigaste råvaraorna för den svenska kemiska industrin, och framför allt för tillverkning av cellulosa genom sulfatprocessen.
En kemisk fabrik. Förutsättningarna för denna tradition är mycket goda eftersom gran, i regel arten Picea abies, är allmän över hela landet med undantag för de sydligaste delarna. Gran är också en av de viktigaste råvaraorna för den svenska kemiska industrin, och framför allt för tillverkning av cellulosa genom sulfatprocessen.
Granved kan delas upp två klart åtskilda fraktioner, fibrer och extraherbara föreningar. Träets fibrer är uppbyggda av polymerer med hög molekylvikt, cellulosa, hemicellulosa och lignin medan extraktivämnena utgöres av organiska föreningar med tillräckligt låg molekylvikt för att vara lösliga i neutrala organiska lösningsmedel eller vatten. Extraherbara organiska ämnen skiljer sig från träets andra beståndsdelar genom att de inte utgör en del av cellernas struktur.
 Cellulosa. Cellulosa är den dominerande beståndsdelen i trä (den svarar för omkring 40 % av den totala massan). Cellulosa är en polymer med en bred molekylviktsfördelning som innehåller omkring 7000 alfa-D-glykos-enheter. Den är huvudingrediensen i papper och pappersmassa.
Cellulosa. Cellulosa är den dominerande beståndsdelen i trä (den svarar för omkring 40 % av den totala massan). Cellulosa är en polymer med en bred molekylviktsfördelning som innehåller omkring 7000 alfa-D-glykos-enheter. Den är huvudingrediensen i papper och pappersmassa.
Hemicellulosa är också en kolhydrat-polymer, men med avsevärt kortare molekyler än cellulosa. Den består av omkring 150 monomera enheter, vilka kan utgöras av mannos-, xylos- och galaktos-enheter. Vid framställning av pappersmassa på kemisk väg bryts hemicellulosan ner till enkla kolhydrater som går i lösning i avfallslutarna.
Man känner ännu inte till den fullständiga och precisa strukturen för lignin, men under senare år har man gjort stora framsteg i denna riktning. Vi vet att lignin består av en polymer av substituerade fenylpropan-enheter, sammanbundna till en amorf tredimensionell struktur med flera olika typer av kemiska bindningar. Ligninets sammansättning varierar mellan olika sorters trä.
Forskning över ligninets struktur försvåras av det faktum att polymeren är sammanvävd med cellulosan och hemicellulosan. Det är därför nödvändigt att bryta ner ligninet för att kunna få det i lösning.
Ett typiskt extrakt av lignin från barrträd innehåller omkring 80 % coniferylalkohol, 14 % cumarylalkohol och 6 % sinapylalcohol.
 Gran. Huvudmålet för den kemiska massaberedningen är att lösa upp ligninet och återvinna cellulosan från träet. Det upplösta ligninet är huvudkomponenten i avfallslutarna, vilka tilldrar sig stor uppmärksamhet från kemister som forskar över ligninanvändning i samband med pappers- och pappersmasseframställning.
Gran. Huvudmålet för den kemiska massaberedningen är att lösa upp ligninet och återvinna cellulosan från träet. Det upplösta ligninet är huvudkomponenten i avfallslutarna, vilka tilldrar sig stor uppmärksamhet från kemister som forskar över ligninanvändning i samband med pappers- och pappersmasseframställning.
Kvantiteten extraherbart material i gran kan variera från flera procent upp till så mycket som 25 till 35 %. De extraherade föreningarna omfattar många typer av organiska föreningar och täcker praktiskt taget hela spektrat av kända föreningar. Organiska kemister som undersöker extraktivämnen träffar ofta på nya organiska föreningar som inte var kända tidigare.
Den olja, som erhålles när man avlägsnar lösningsmedlet från ett extrakt av granträ, kan uppdelas i terpentin, tallolja och resin. Terpentin innehåller i huvudsak alfa- och beta-pinen samt delta3-karene.
Tallolja är en blandning främst av alfa-terpineol, tillsammans med terpen-kolväten, syror, aldehyder, alkoholer, etrar, ketoner och fenoler.
Omkring 90 % av den återstående heta resinen består av resin-syror, vilka är diterpener av abietan- och pimar-typ.
De roll som extraktivämnena spelar står inte i proportion till den mängd som finns närvarande i träet. Inte desto mindre är de ansvariga för många av granens speciella egenskaper, som t.ex. den färg och doft som i så stor utsträckning bidrar till julstämningen.
Stearinljus
Författare: Mats Ahlberg
Sverige, och då i synnerhet den nordligaste delen, brukar ofta presenteras som "Midnattssolens Land". Men detta gäller bara under sommaren, och om man inte drar söderöver med flyttfåglarna utan stannar kvar för att fira jul finner man att varje dag med midnattssol måste betalas med en dag av kompakt mörker. Denna mörka tid är den årstid när man tänder ljus i Sverige. Ljusen inte bara lyser upp mörkret, utan skapar också den romantiska atmosfär i vilken svenskarna firar julen.
 Färgskiftande stearinljus. Romarna använde ljus som var tillverkade av bivax. Under 1100-talet infördes talgljus, och 1825 fick M. E. Chevreul och J. L. Gay-Lussac patent på ljus av stearin. Moderna ljus tillverkas av en blandning av hård paraffin (smältpunkt 51-55 °C) och stearin. Stearin, som tillsätts för att höja smältpunkten och förlänga brinntiden, består av en blandning av palmitinsyra och stearinsyra med smältpunkterna 61 och 69 °C, respektive.
Färgskiftande stearinljus. Romarna använde ljus som var tillverkade av bivax. Under 1100-talet infördes talgljus, och 1825 fick M. E. Chevreul och J. L. Gay-Lussac patent på ljus av stearin. Moderna ljus tillverkas av en blandning av hård paraffin (smältpunkt 51-55 °C) och stearin. Stearin, som tillsätts för att höja smältpunkten och förlänga brinntiden, består av en blandning av palmitinsyra och stearinsyra med smältpunkterna 61 och 69 °C, respektive.
Ljusvekar görs av flätad bomullstråd som betats med borsyra, salmiak och fosfater eftersom ren bomull skulle brinna för snabbt och dessutom ryka. Genom att fläta veken platt kommer den att böja sig när den förkolnar, luta ut ur ljuslågan och brinna upp. Cellulosan i veken reagerar då med betsalterna i en sönderdelning som inte ger upphov till aska.
När ett ljus väl har tänts kommer värmen från lågan att smälta vaxet, vilket sedan sugs upp längs veken av kapillärkraften och förångas. De frigjorda kolvätemolekylerna kommer sedan att verka på flera olika sätt i förbränningsprocesserna.
En ljuslåga kan vetenskapligt klassificeras som en diffusionsflamma, vilket betyder att luft diffunderar in i bränslet i flamman. En annan typ av flamma är den förblandade flamman i vilken bränsle och luft blandas innan förbränningen. En förblandad flamma återfinns t.ex. i Bunsenbrännaren.
(Vad händer förresten om man tänder ett ljus i båda ändar? Titta här!)
Strax ovanför och runtom en brinnande veke finns en mörk zon och ovanför den ett lysande gult område. Längst ner är lågan ljust blå. Temperaturen i den mörka zonen är ganska låg, omkring 600 °C, och ökar till omkring 1200 °C i mitten av det gula området. Den högsta temperaturen, 1400 °C återfinner man i den övre ytterkanten av den lysande gula delen av lågan.
Förångade kolvätemolekyler sönderdelas stegvis av hettan i den mörka zonen intill veken, främst genom förlust av C2H4- och CH2-radikaler. Den ljusa blå zonen längst ner är en reaktionszon. Den blå färgen beror främst på utstrålning från två exciterade molekyler, C2 och CH, vilka bildas i exciterat tillstånd genom de reaktioner som skapar dem.
Reaktionszonen fortsätter uppåt runtom lågans gula område. Här reagerar radikaler från de sönderdelade kolvätena med syre från luften under bildning av CO2 och vatten i en komplicerad reaktion som ännu inte är förstådd fullt ut. Någon direktkontakt mellan icke sönderdelat bränsle och luft finns inte, eftersom dessa båda komponenter hålls åtskilda av ett lager av förbränningsprodukter.
Den intressantaste delen av lågan är det lysande gula området, från vilket huvuddelen av ljusutstrålningen kommer. Detta område kallas också kolzonen eftersom det består av sotpartiklar av kol. Dessa bildas överst i den mörka zonen från söndedelade kolväten, vilka har en hög halt av kol eftersom förhållandet väte/kol är lågt.
De ursprungliga sotpartiklarna varierar i storlek från 10 till 200 nm, och så småningom klumpar de ihop sig till långa kedjor. De värms upp av de heta förbränningsgaserna och av värmestrålningen från reaktionszonen så att de börjar glöda. Ljus utstrålas inom hela det synliga spektrum, men utstrålningen är intensivast inom de gula våglängderna. När de glödande sotpartiklarna stiger upp genom det gula området förbrukas de genom reaktion med vatten och koldioxid under bildning av CO.
Om veken inte böjs ut ur lågan och förbränns, kommer den att bli för lång och för mycket bränsle kommer att tillföras lågan. I ett sådant fall kommer lågan att sota eftersom inte alla sotpartiklar hinner förbrännas. Det är då nödvändigt att förkorta veken genom att klippa ner den.
 Ljus i glas. När syret förbrukas, sugs vattnet upp i glaset. Du kan förvissa dig själv om reaktionsförloppet i en låga genom att göra följande försök. Håll först ett stycke kall metall, t.ex. en sked, strax ovanför lågan. Du kan se hur vatten, som bildats vid förbränningen, kondenseras på metallen.
Ljus i glas. När syret förbrukas, sugs vattnet upp i glaset. Du kan förvissa dig själv om reaktionsförloppet i en låga genom att göra följande försök. Håll först ett stycke kall metall, t.ex. en sked, strax ovanför lågan. Du kan se hur vatten, som bildats vid förbränningen, kondenseras på metallen.
Stick in skeden i mitten av det gula området. Den kommer då att sotas ner av oförbrukade kolpartiklar. Om du håller skeden i den mörka zonen, straxt ovanför veken, kommer förångade och ännu ej sönderdelade kolväten att kondensera på den som en hinna av vax.
Om du blåser ut ljuset kommer du att se en strimma vit rök. Den består av kolväten som förångats från den ännu varma veken och sedan kondenserats till ett aerosolmoln av droppar med en medeldiameter om ungefär 0,15 mikrometer. Om du snabbt för en tänd tändsticka mot rökstrimman kommer denna att fatta eld och flamman röra sig ned mot veken och antända den senare på nytt.
Mindre än 0,4 % av den energi som bildas när ett ljus brinner utstrålas i form av synligt ljus. Den mesta strålningen utsänds som värmestrålning inom det infraröda området. Detta är gynnsamt, eftersom vinternätter i Sverige inte bara är mörka utan också kalla, och den värme du får från ljuset är i det långa loppet betydligt bättre för ditt välbefinnande än den värme du kan få från överkonsumtion av fet skinka och snaps.
Snö och is
En svensk jul är oftast en vit jul, och man tar snön och isen för givna och gläds åt dem utan att närmare fundera över dessa ämnens anmärkningsvärda egenskaper. Utgångsmaterialet för snö och is är vatten, två väteatomer och en syreatom sammanfogade till en liten, lätt molekyl. Egentligen borde vatten vid rumstemperatur vara en gas, i likhet med andra lika lätta molekyler, t.ex. ammoniak och svavelväte. (Jodå, ammoniak är faktiskt en gas; den vätska man ibland kallar ammoniak är en vattenlösning av gasen.) Att vatten är en vätska och inte en gas beror på vätebindningar.
.jpg) En vattenmolekyl. Syreatomen i en vattenmolekyl suger begärligt åt sig en del av de elektronmoln som rätteligen hör hemma runt de två väteatomerna. Detta resulterar i att väteatomerna får en positiv laddning och syreatomen en negativ. Eftersom motsatta laddningar attraherar varandra kan nu den negativa syreatomen dras till en positiv väteatom i en annan molekyl. Vi har fått en vätebindning mellan de två molekylerna. Genom att varje vattenatom har två väteatomer kan dessa binda till två andra vattenmolekyler. På så sätt uppstår det komplexa nätverk av löst förenade molekyler som ger vatten, snö och is deras speciella egenskaper.
En vattenmolekyl. Syreatomen i en vattenmolekyl suger begärligt åt sig en del av de elektronmoln som rätteligen hör hemma runt de två väteatomerna. Detta resulterar i att väteatomerna får en positiv laddning och syreatomen en negativ. Eftersom motsatta laddningar attraherar varandra kan nu den negativa syreatomen dras till en positiv väteatom i en annan molekyl. Vi har fått en vätebindning mellan de två molekylerna. Genom att varje vattenatom har två väteatomer kan dessa binda till två andra vattenmolekyler. På så sätt uppstår det komplexa nätverk av löst förenade molekyler som ger vatten, snö och is deras speciella egenskaper.
När vatten fryser bildas is, vätska övergår i ett fast ämne. Men inte fullständigt. Kvar på isens yta blir ett lager av vattenmolekyler som inte riktigt inordnat sig i iskristallens fasta struktur. I stället beter de sig fortfarande nästan som en vätska. Tjockleken av detta lager beror på temperaturen. Under -40 °C är lagret bara några få vattenmolekyler tjockt (mindre än en miljondels millimeter!) medan straxt under 0 °C kan tjockleken uppgå till flera hundra vattenmolekyler.
Det är just genom att lagret nästan är en vätska som isen blir hal. Man kan likna vattenmolekylerna i lagret vid kullagerkulor, tätt utströdda på ett golv. Försök att gå runt på det golvet utan att halka! Eller tänk på hur en tunn vattenfilm på vägen kan resultera i att bilar halkar runt okontrollerbart p.g.a. vattenplaning.
Det är också tack vare detta lager som det går att krama snöbollar. Då fungerar lagret ungefär som ett klister som binder samman snöflingorna. Ju mera "klister", desto bättre går det. Det är därför som den bästa kramsnön fås vid temperatur runt 0 °C när lagret är som tjockast.
 Snöflingor - iskristaller. Snö är helt enkelt speciella former av iskristaller. Man kan skilja mellan:
Snöflingor - iskristaller. Snö är helt enkelt speciella former av iskristaller. Man kan skilja mellan:
- Snökristaller, som är enkla iskristaller, oftast med sexfaldig symmetri, vars storlek varierar från mikroskopisk till några få millimeter,
- Snöflingor, som består av löst "sammanklistrade" snökristaller. Nära 0 °C, när kristallernas "klisterlager" är som tjockast, kan flingorna växa till 10 cm storlek;
- Rimfrost, som uppstår när underkylda vattendroppar, t.ex. i dimma, träffar en fast yta och snabbt fryser; och
- Hagel, som består av stora, fasta klumpar av ihopsintrade iskristaller.
 Iskristall - snöflinga. Om man tittar på snökristaller med förstoringsglas kan man se två huvudtyper: sexfaldigt symmetriska plattor och diverse pelarliknande former. Vilken typ som främst bildas beror på temperatur och luftfuktighet i molnet där snön uppstår. Vid temperaturer under -25 °C bildas i första hand pelarlika kristaller, nålar eller ihåliga stavar. De vackraste snöflingorna, sexkantiga plattor med rikt förgrenade utskott, får man när molnet är övermättat med vattenånga vid 0 – -3 °C eller -12 – -16 °C.
Iskristall - snöflinga. Om man tittar på snökristaller med förstoringsglas kan man se två huvudtyper: sexfaldigt symmetriska plattor och diverse pelarliknande former. Vilken typ som främst bildas beror på temperatur och luftfuktighet i molnet där snön uppstår. Vid temperaturer under -25 °C bildas i första hand pelarlika kristaller, nålar eller ihåliga stavar. De vackraste snöflingorna, sexkantiga plattor med rikt förgrenade utskott, får man när molnet är övermättat med vattenånga vid 0 – -3 °C eller -12 – -16 °C.
 Iskristall - snöflinga. Hur uppstår dessa rikt förgrenade plattor? Det börjar med ett kallt moln och en kondensationskärna, en mikroskopiskt liten partikel som kan fungera som en startpunkt för isbildningen. Den kan bestå av jord, vulkanaska, damm, eller t.o.m. vara av utomjordiskt ursprung. (Jorden träffas varje år av 40 000 ton småpartiklar från himlen.) Det går också att starta processen på konstgjord väg genom att beså molnet med silverjodid-kristaller.
Iskristall - snöflinga. Hur uppstår dessa rikt förgrenade plattor? Det börjar med ett kallt moln och en kondensationskärna, en mikroskopiskt liten partikel som kan fungera som en startpunkt för isbildningen. Den kan bestå av jord, vulkanaska, damm, eller t.o.m. vara av utomjordiskt ursprung. (Jorden träffas varje år av 40 000 ton småpartiklar från himlen.) Det går också att starta processen på konstgjord väg genom att beså molnet med silverjodid-kristaller.
 Iskristaller - Snöflingor. Runt kristallisationskärnan bildas en sexkantig platta av is. Att plattan blir sexkantig beror på att detta är det stabilaste sättet att gruppera vattenmolekylerna i en iskristall. Eftersom plattans hörn s.a.s. sticker ut har hörnen lättare än långsidorna för att fånga upp vattenmolekyler ur det omgivande molnet och börjar därför växa snabbare. På så sätt kommer de att spreta ut mer och mer och förgreningarna uppstår. Genom att den växande snökristallen virvlar runt i molnet kommer den att utsättas för olika temperatur-luftfuktighets-kombinationer, var och en resulterande i ett specifikt tillväxtmönster. Förgreningsmönstret kommer på så sätt att varieras i det oändliga och alla snökristaller blir olika.
Iskristaller - Snöflingor. Runt kristallisationskärnan bildas en sexkantig platta av is. Att plattan blir sexkantig beror på att detta är det stabilaste sättet att gruppera vattenmolekylerna i en iskristall. Eftersom plattans hörn s.a.s. sticker ut har hörnen lättare än långsidorna för att fånga upp vattenmolekyler ur det omgivande molnet och börjar därför växa snabbare. På så sätt kommer de att spreta ut mer och mer och förgreningarna uppstår. Genom att den växande snökristallen virvlar runt i molnet kommer den att utsättas för olika temperatur-luftfuktighets-kombinationer, var och en resulterande i ett specifikt tillväxtmönster. Förgreningsmönstret kommer på så sätt att varieras i det oändliga och alla snökristaller blir olika.
Tomtebloss
Författare: Erik Dahlgren
En lysande svensk jultradition är att använda tomtebloss eller julgransbloss för att dekorera och lysa upp julgranen. De kan också användas tillsammans med facklor vid färden till julottan, och till och med ibland för att i största allmänhet lysa upp tillvaron.
 Tomtebloss. Ett tomtebloss är omkring 10 cm långt och har en brinntid om cirka en minut.
Tomtebloss. Ett tomtebloss är omkring 10 cm långt och har en brinntid om cirka en minut.
Pyroteknisk kemi är synnerligen komplicerad, och det gäller fortfarande att i betydande utsträckning pröva sig fram och till och med praktisera varjehanda former av hokuspokus när man konstruerar och tillverkar pyroteknikpjäser.
Den ökända lärosatsen: "Corpora non agent nisi fluida" ("Kroppar reagerar inte om de ej är i vätskeform"), vilken tillskrivs Aristoteles, styrde det kemiska tänkandet ända fram till 1900-talet. Det var först 1912 som Hedvall presenterade de första bindande bevisen för att fasta kroppar själva kan reagera.

A Schottky vacancy or Frenkel interstitial
Participation is real, not artificial
Defect or hole
They play a role
On the surface that's not superficial.Mc Lain
Ett recept på tomtebloss kan du se på den här länken. (Glöm inte att du måste söka tillstånd hos räddningsverket om du gör det på skolan!)
Vid reaktionen mellan Ba(NO3)2 och Al frigörs värme, vilket får järnfilspånen att glöda. Genom glöden bildas ett svagt gastryck, som får de glödande spånen att kastas ut som gnistor. Gnistorna svalnar mycket snabbt, och skulle en gnista träffa huden känner man ingen eller nästan ingen hetta. Koppartråden har en viktig funktion som värmeledare och svarar för att reaktionszonen förflyttas på ett lugnt och säkert sätt längs tomteblosset när det brinner.
Ett vanligt problem vid tomteblosstillverkning är tendensen hos (Ba(NO3)2), Fe och Al att reagera i suspensionen, t.ex. på följande sätt:
36H2O + 16Al + 3Ba(NO3)2 ⇌ 3Ba(OH)2 + 16Al(OH)3 + 6NH3
Denna reaktion kan upptäckas genom ammoniaklukten, och den kan hållas under kontroll genom att hela tiden hålla pH på den sura sidan genom tillsats av en svag syra, t.ex. borsyra. (En starkare syra skulle angripa aluminiumflagorna och järnfilspånen.) Järnfilspånen i blandningen ges ofta en tunn skyddande vaxhinna för att minimera korrosionen i vattensuspensionen.
Torkningen av tomtebloss kräver också stor omsorg. Vid för snabb torkning bildas en skorpa på ytan som innesluter fukt, vilket kan leda till sönderdelning och rostning.
Ett tomtebloss är en av de svåraste pyrotekniska satserna att tillverka. Om någon av ingredienserna inte riktigt håller måttet, eller om proportionerna inte är exakt de rätta kommer blosset inte att fungera som det skall, och om torkningen är för snabb eller lagringen sker vid för hög luftfuktighet blir resultatet en undermålig produkt.
Lycka till med blossandet och god jul!
Glögg
Glögg gick ursprungligen under namnet "glödgat vin" och var en betydligt alkoholsvagare produkt än dagens glögg. Närmast påminde 1800-talets glögg om det "Glühwein" som i dag serveras t.ex. på vintersportorter i Österrike och Schweiz.
 Gustafwa Björklunds kokbok. Gustava Björklunds recept från omkring 1880 utgår från en flaska rödvin som blandas med halva mängden vatten. Tre krossade kryddnejlikor tillsätts tillsammans med en bit kanel och socker efter smak. Blandningen får sedan koka en stund innan den serveras. Kokningen fyller två funktioner: att påskynda extraktion av smakämnen från kryddorna och att påskynda avdunstning av alkohol.
Gustafwa Björklunds kokbok. Gustava Björklunds recept från omkring 1880 utgår från en flaska rödvin som blandas med halva mängden vatten. Tre krossade kryddnejlikor tillsätts tillsammans med en bit kanel och socker efter smak. Blandningen får sedan koka en stund innan den serveras. Kokningen fyller två funktioner: att påskynda extraktion av smakämnen från kryddorna och att påskynda avdunstning av alkohol.
Det kontinentala "Glühwein" bereds fortfarande på ett liknande sätt, men sockret byts ofta ut mot honung, och apelsin- eller citronskal kan tillsättas.
Den svenska glöggen blev så småningom allt starkare. Ett skäl kan ha varit upptäckten att karamelliserat socker förbättrade smaken, och att bästa sättet att genomföra karamelliseringen av sockret var att placera det på ett nät ovanför glöggen, tända på alkoholångorna och låta den brinnande alkoholen göra jobbet.
Detta kräver emellertid att glöggens alkoholhalt ligger åtminstone på starkvinsnivå, d.v.s. minst 20 volyms-%. Eftersom förångningen och den följande avbränningen åtminstone halverar alkoholhalten kom dock karamelliseringen att snart betraktas som ett slöseri. I dag används denna process knappast vid hemberedning av glögg.
 Återloppskokning. Under karamelliseringen bildas mörkbruna, högmolekylära polymerer tillsammans med diverse lågmolekylära smakämnen. Denna blandning används också på annat håll som livsmedelskosmetika, t.ex. i imiterad sojasås och i mörkfärgade öltyper.
Återloppskokning. Under karamelliseringen bildas mörkbruna, högmolekylära polymerer tillsammans med diverse lågmolekylära smakämnen. Denna blandning används också på annat håll som livsmedelskosmetika, t.ex. i imiterad sojasås och i mörkfärgade öltyper.
Samtidigt som alkoholhalten genom åren gradvis ökade, tillsattes också allt mer kryddor. Dagens glögg har ganska litet gemensamt med förra århundradets glödgade vin.
Många recept på glögg finns tillgängliga på webben. Du kan t.ex. prova professorns glögg eller en lättblandad glögg eller ett recept från Webtender eller en tyskinspirerad glögg eller t.o.m. en ganska säregen brygd. Men en sann kemist bör bereda glögg på följande sätt:
Återloppskoka 4 l rödvin och 1 l 96 % alkohol tillsammans med 25 g vardera av kryddnejlikor, kanelstång, grovkrossad muskot och torkade pomeransskal under åtminstone två timmar för att extrahera kryddornas smakämnen. Överför den varma vätskan till en 5 l bägare, täck med ett nät av rostfritt stål (INTE koppar!) och lägg 300-400 g sockerbitar på nätet. Tänd på alkoholångorna och låt lågorna smälta och karamellisera sockret så att den bildade produkten droppar ned i vin-alkohol-blandningen Filtrera vätskan, tillsätt 25 ml tinctura aromatica (från apotek!), 250 g skållad mandel och 250 g russin och värm på nytt (t.ex. i mikrovågsugn) utan att glöggen börjar koka. Servera så varmt som möjligt!