Vätebindningar
Vätebindningar
Uppstår mellan två molekyler.
I den ena molekylen:
- En väteatom bunden till en starkt elektronegativ atom (vanligast O, N och F).
I den andra molekylen:
- En elektronegativ atom med minst ett fritt elektronpar.
I den första molekylen:
- Den elektronegativa atomen drar åt sig så mycket av elektronerna, att väteatomen blir helt fri från elektroner.
- Väteatomen – fast nu är det ju bara en vätejon, alltså en proton – kan pysa iväg till den andra elektronegativa atomen, som "lånar ut" sitt fria elektronpar till vätet.
Den första och den andra molekylen delar på en proton – detta är själva vätebindningen!
- Jämför med elektronparbindningen – i den delar två atomer på ett elektronpar.
Vätebindningen är en relativt stark intermolekylär bindning.
Det ovanliga vattnet
Mellan vattenmolekylerna bildas det vätebindningar.
- Varje vattenmolekyl kan delta i fyra vätebindningar: Den kan "skänka bort" två väteatomer, och den kan ta emot två väteatomer.
De många vätebindningarna ger upphov till ytspänning.
- Ytspänningen gör att vatten kan stiga upp i smala rör (kapillärkraften).
- Ytspänningen gör också att djur som insekter (t.ex. skräddare) kan gå på vattnet.
(Säg hej till "Jesusödlan"!) 😎
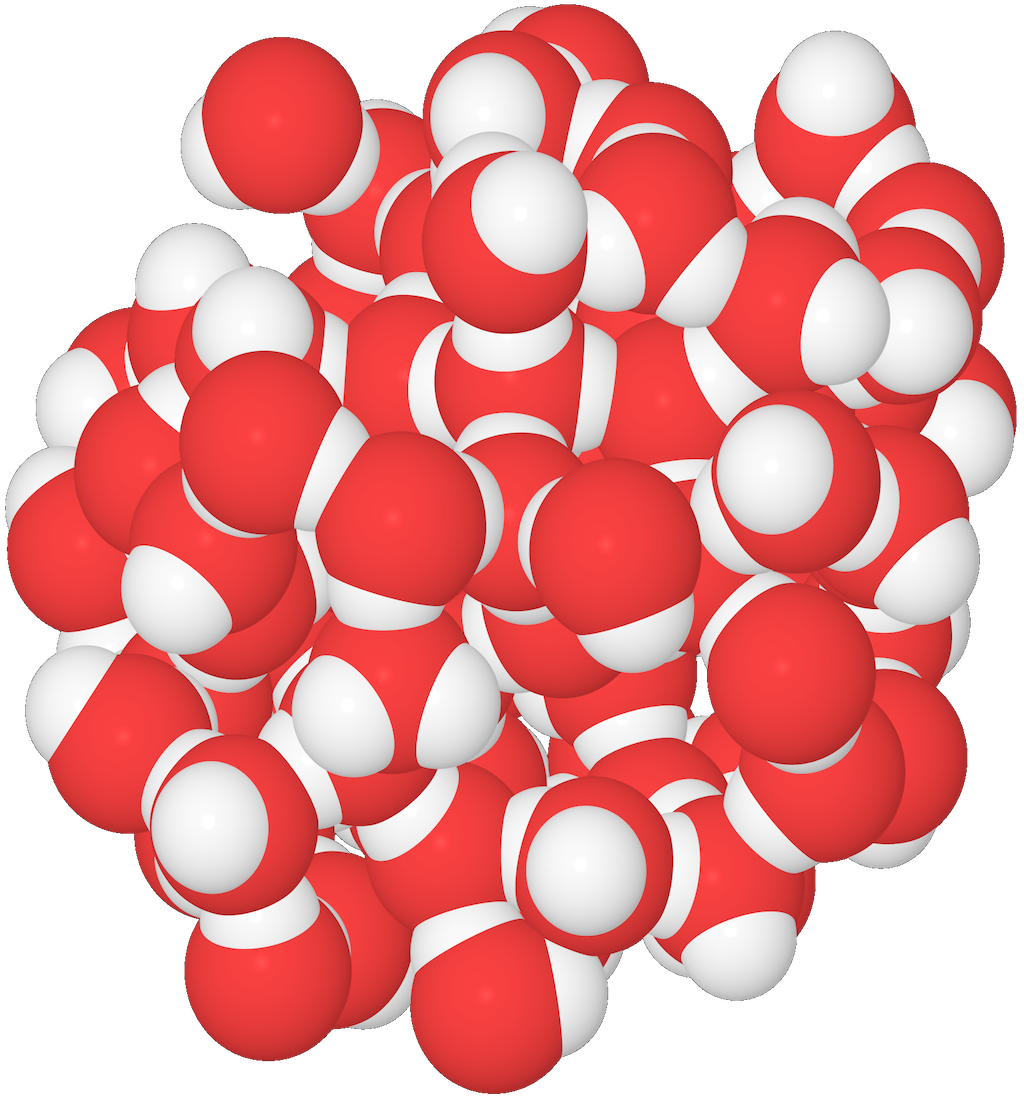
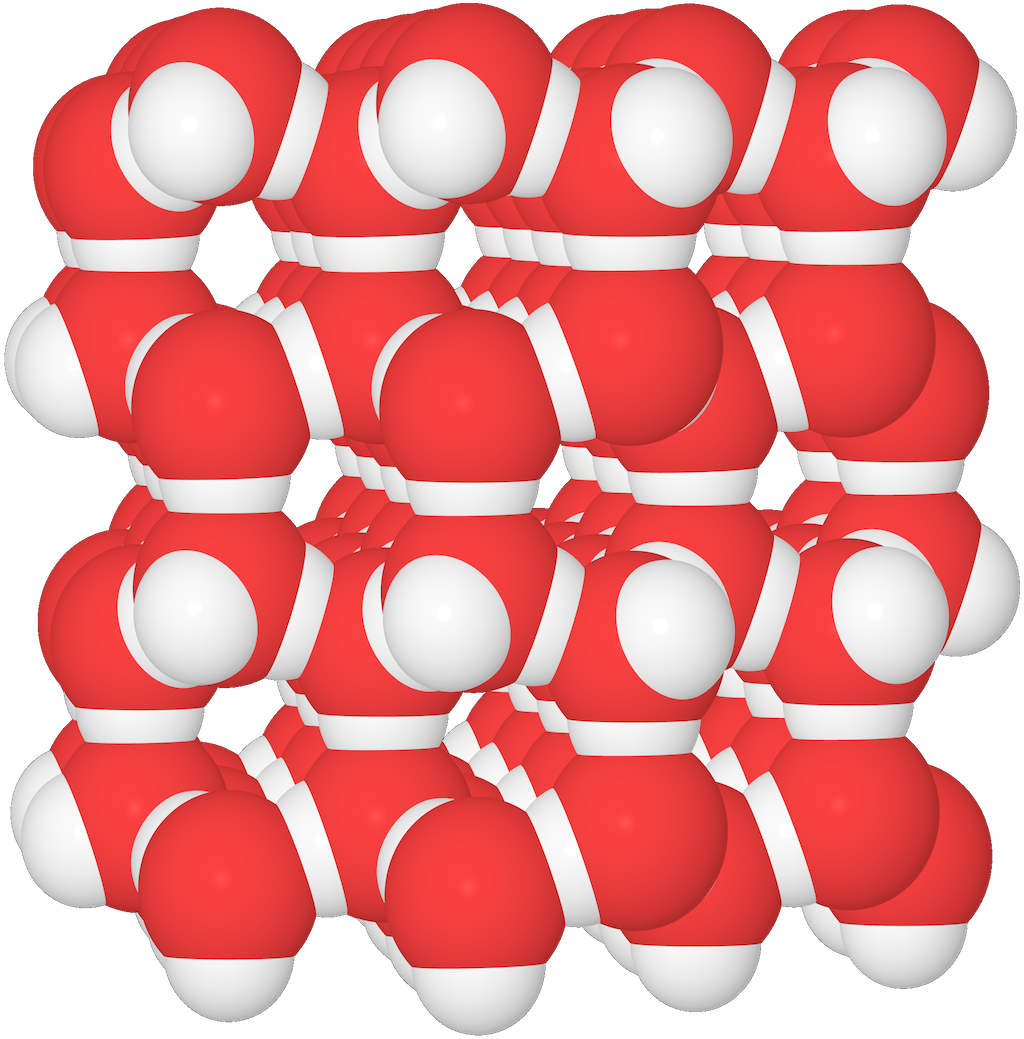
Flytande vatten och is
I flytande vatten kan vattenmolekylerna packas tätare än i is.
- Det beror på att när temperaturen sjunker, låses vattenmolekylerna fast i vätebindningarna.
Lägg märke till de tomma utrymmena mellan vattenmolekylerna i isen!
- Detta gör att isen får lägre densitet – och att den flyter ovanpå vattnet. Det hade inte varit möjligt utan vätebindningarna.
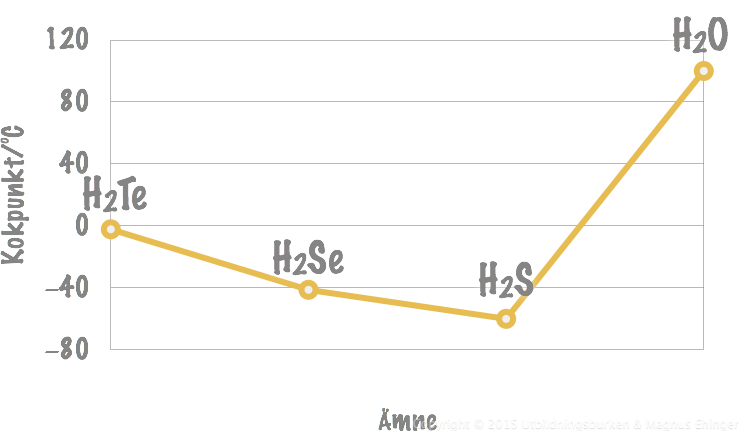 Kokpunkt för några föreningar i syregruppen.
Kokpunkt för några föreningar i syregruppen.
I syregruppen i den periodiska systemet hittar vi följande grundämnen:
- O, S, Se, Te och Po
Tellur är en större atom än selen ⇒ fler elektroner som rör sig och kan bilda starkare tillfälliga dipoler ⇒ starkare van der Waalsbindningar mellan H2Te-molekylerna och högre kokpunkt för H2Te än H2Se.
Kokpunkten sjunker också för H2S – Men stiger plötsligt för H2O!
- Detta är tack vare vätebindningarna.
- Vätebindningarna är starkare än van der Waalsbindningarna.
- Mer energi krävs för att bryta bindningarna mellan H2O-molekylerna ⇒ högre kokpunkt för vatten.