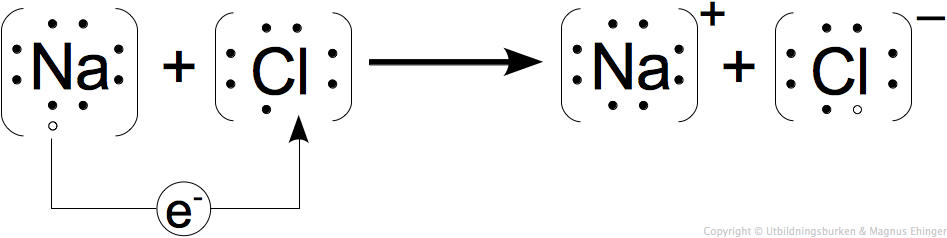
Reaktionen kan beskrivas på följande sätt:
| K | L | M | K | L | M | K | L | M | K | L | M | |||||||
| 11p+ | 2e– | 8e– | 1e– | + | 17p+ | 2e– | 8e– | 7e– | → | 11p+ | 2e– | 8e– | 0 | + | 17p+ | 2e– | 8e– | 8e– |
| natriumatom, Na | kloratom, Cl | natriumjon, Na+ | kloridjon, Cl– | |||||||||||||||
- Lägg märke till hur elektronen i natriumatomens M-skal flyttar sig till kloratomens M-skal!
- Lägg märke till att natriumjonen blir envärt positiv, Na+, eftersom den släpper ifrån sig en elektron.
- Lägg märke till att kloridjonen blir envärt negativ, Cl–, eftersom den tar upp en elektron.
Man kan också visa det med elektronformler:
Man kan också visa det med en kemisk formel:
- Na + Cl → Na+ + Cl–
Men i klorgas kommer ju alltid atomerna två och två!
Reaktionsformeln blir sålunda:
- 2Na + Cl2 → 2NaCl
Spontana reaktioner
När natrium och klor reagerar, frigörs mycket värme.
När frigörs energi?
- När det uppstår bindningar!
Lite energi behövs för att ta bort elektronen från natriumatomen.
Men mycket energi frigörs när elektronen tas upp av kloratomen, och det uppstår en jonbindning mellan Na+ och Cl–.
Natriumklorid är en stabil förening
Det frigjordes mycket energi när den bildades.
Det krävs mycket energi för att bryta bindningarna mellan Na+- och Cl–-jonerna.
- Smältpunkt: 801 °C
- Kokpunkt: 1413 °C
Salter
Salter är jonföreningar.
Metall + icke-metall
Metallen bildar en positivt laddad jon.
- Metallatomerna släpper ifrån sig en eller flera elektroner.
Icke-metallen bildar en negativt laddad jon.
- Icke-metallatomerna tar upp elektronerna från metallen.
Exempel: Magnesium reagerar med klor.
Vad bildas?
Ordformel:
- Magnesium + klor → magnesiumklorid
Kemisk formel:
- Mg + Cl2 → MgCl2
Varför blir den så?
| Varje magnesiumatom släpper ifrån sig två elektroner: | Mg → Mg2+ + 2e– |
| Varje kloratom tar upp en elektron: | Cl + e– → Cl– |
| Men i klorgas kommer ju alltid atomerna två och två: | Cl2 + 2e– → 2Cl– |
| Alltdå blir formeln: | Mg + Cl2 → MgCl2 |
Atomjoner och sammansatta joner
Salter av atomjoner
Jonerna består endast av ett atmoslag.
- Exempel: Na+Cl– (fast oftast skriver vi den ju bara NaCl).
Sammansatta joner
Jonerna består av flera atomslag.
Exempel: Sulfatjonen, SO\({\sf_4^{2-}}\)
Fyra syreatomer binder till en svavelatom.
Hela strukturen är tvåvärt negativ:
Kopparsulfat: CuSO4 innehåller en atomjon (Cu2+) och en sammansatt jon (SO\( _4^{2-}\)).
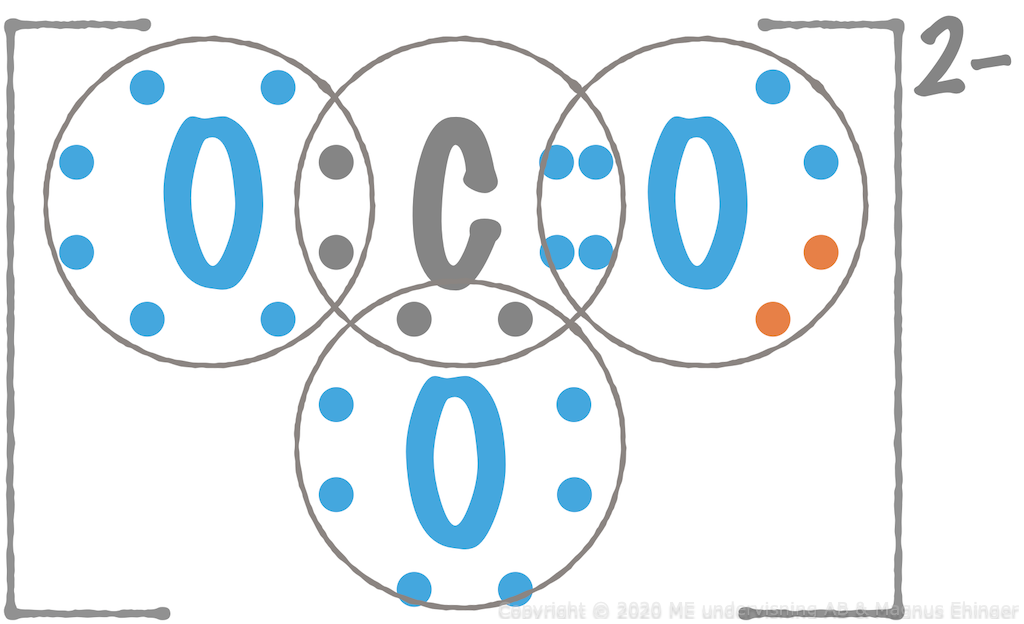
Exempel: Karbonatjonen, CO\({\sf_3^{2-}}\)
Karbonatjonen är tvåvärt negativ:
Visa hur karbonatjonerna, CO\( _3^{2-}\) sitter i förhållande till calciumjonerna, Ca2+ i kalciumkarbonat i modellen till höger.