Videogenomgång (flippat klassrum)
English-speaking or IB student? Check out the English version instead!
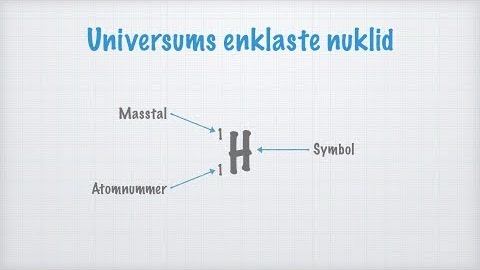 Hur mycket väger en proton/neutron/elektron?
Hur mycket väger en proton/neutron/elektron?
Pyttelite!!!
Exempel: protonen väger 1,637 · 10–27 kg.
- Otympligt!
Istället har man infört enheten ”u” = "Den universella massenheten".
- Fysikaliska kemister använder traditionellt gärna u, medan proteinkemister istället gärna använder enheten Da (Dalton).
- 1 Da = 1 u
- Exempel: protonen väger 1,007 u
Att kunna:
Protonen & neutronen väger ungefär 1 u = 1 Da
Elektronen väger ungefär 1/1800 u
Atomnummer
Antalet protoner avgör vilket atomslag det rör sig om.
- Antalet protoner = atomnumret
Exempel
| Atomslag | atomnummer | antal protoner |
| Väte (H) | 1 | 1 |
| Helium (He) | 2 | 2 |
| Kol (C) | 6 | 6 |
| Klor (Cl) | 17 | 17 |
Masstal
Men i atomerna med högre atomnummer, måste vi ha med neutroner också (för att protonerna inte skall stötas bort från varandra)!
- Ett atomslag med ett visst antal p+ och n kallas en nuklid.
- Olika nuklider av samma grundämne kallas isotoper.
- En nuklids masstal = antalet protoner + antalet neutroner
- \(A = Z + N\)
Nukliders symboler skrivs generellt på formen: \( ^{\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{masstal}}_{\text{atomnummer}}\text{Symbol}\)
| Nuklid | atomnummer | antal p+ | antal n | masstal |
| väte, \(^1_1\text{H}\) | 1 | 1 | 0 | 1 |
| deuterium, \(^2_1\text{H}\) | 1 | 1 | 1 | 2 |
| tritium, \(^3_1\text{H}\) | 1 | 1 | 2 | 3 |
| helium, \(^4_2\text{He}\) | 2 | 2 | 2 | 4 |
| kol-12, \(^{12}_{\text{ }\text{ }6}\text{C}\) | 6 | 6 | 6 | 12 |
| kol-13, \(^{13}_{\text{ }\text{ }6}\text{C}\) | 6 | 6 | 7 | 13 |
| kol-14, \(^{14}_{\text{ }\text{ }6}\text{C}\) | 6 | 6 | 8 | 14 |
| klor-35, \(^{35}_{17}\text{Cl}\) | 17 | 17 | 18 | 35 |
| klor-37, \(^{37}_{17}\text{Cl}\) | 17 | 17 | 20 | 37 |
Atommassa
Kommer du ihåg: Hur mycket väger en proton? 1,637 · 10–27 kg.
- Otympligt!
Kommer du ihåg: Hur mycket väger en proton i enheten u?
- 1,007 u
Hur har man definierat enheten u (universella massenheten)?
Man bestämde helt enkelt att en atom kol-12, \( ^{12}_{\text{ }\text{ }6}\text{C}\), skulle ha massan exakt 12 u.
Vi kan skriva det såhär: \( m_{^{12}_{\text{ }\text{ }6}\text{C}} \equiv 12\text{u}\) eller såhär: \(1\mathrm{u} \equiv \frac {m_{^{12}_{\text{ }\text{ }6}\text{C}}}{12}\)
- Det ”trippla likhetstecknet” läses ut ”är exakt lika med”, dvs. ”är definierat som”.
En titt i periodiska systemet
Kloratomens atommassa anges till c:a 35,5 u.
Hur kan detta vara? Masstalet är ju antalet protoner + antalet neutroner — inte finns det väl några "halva" neutroner eller protoner??
Nej. Men såhär ligger det till:
- Klor förekommer i två isotoper, klor-35 och klor-37
- 75% av allt klor är klor-35, och 25% av allt klor är klor-37
Det genomsnittliga masstalet för en kloratom blir sålunda:
- 0,75 · 35 + 0,25 · 37 = 35,5
Samma princip gäller för alla grundämnen:
- De förekommer i olika isotoper.
- Atommassan i periodiska systemet är den genomsnittliga atommassan för det ämnet (atomslaget).