Sida 1 av 2
![]() Tillåtna hjälpmedel är penna, suddgummi och linjal, miniräknare och formelsamling. Samtliga svar ska skrivas på detta pappret. I alla strukturformler ska vätena finnas med. Alla reaktionsformler ska vara balanserade. Glöm inte enhet!
Tillåtna hjälpmedel är penna, suddgummi och linjal, miniräknare och formelsamling. Samtliga svar ska skrivas på detta pappret. I alla strukturformler ska vätena finnas med. Alla reaktionsformler ska vara balanserade. Glöm inte enhet!
Del I. Frågor som bara kräver ett kort svar (endast lösning).
- Vilka tre av följande reaktioner är protolyser? (2p)
- H2O + H2O → H3O+ + OH–
- H2O + SO2 → H2SO3
- CH3COOC2H5 + OH– → CH3COO- + HOC2H5
- H2PO\({\sf _4^{-}}\) + H2PO\({\sf _4^{-}}\) → HPO\({\sf _4^{2-}}\) + H3PO4
- H2O + NH3 → OH– + NH\({\sf _4^+}\)
- En lösnings pH är 13,50. Vilken är vätejonkoncentrationen? (1p)
- Skriv formeln för perklorsyras, HClO4, protolys i vatten! (1p)
- Sätt in rätt antal elektroner (e–) på rätt sida om reaktionspilen, och ange om det rör sig om en reduktion eller en oxidation! (2p)
- H2 → 2H+
- Cr3+ → Cr2+
- I vilka två av följande reaktioner verkar divätefosfatjonen, H2PO\({\sf _4^{-}}\), som bas? (2p)
- H2PO\({\sf _4^{-}}\) + CO\({\sf _3^{2-}}\) → HPO\({\sf _4^{2-}}\) + HCO\({\sf _3^-}\)
- H2PO\({\sf _4^{-}}\) + HSO\({\sf _4^-}\) → H3PO4 + SO\({\sf _4^{2-}}\)
- H2PO\({\sf _4^{-}}\) + OH– → HPO\({\sf _4^{2-}}\) + H2O
- H2PO\({\sf _4^{-}}\) + H2PO\({\sf _4^{-}}\) → HPO\({\sf _4^{2-}}\) + H3PO4
- H2PO\({\sf _4^{-}}\) + H2O → HPO\({\sf _4^{2-}}\) + H3O+
- Studera följande redoxprocess:
Cu2+ + Pb(s) → Cu(s) + Pb2+
- Vilket partikelslag oxideras respektive reduceras? (1p)
- Vilka synliga förändringar kan man iaktta vid processen? (2p)
- I en bägare (nummer 1) med aluminiumkloridlösning stoppar du ner ett zinkbleck, och i en annan bägare (nummer 2) med zinkkloridlösning stoppar du ner ett aluminiumbleck.
- I vilken bägare sker det en reaktion?
- Skriv oxidationsformeln, reduktionsformeln och redoxformeln! (3p)
- Skriv strukturformel och rationellt namn för alla isomerer med molekylformeln C4H9Cl! (4p)
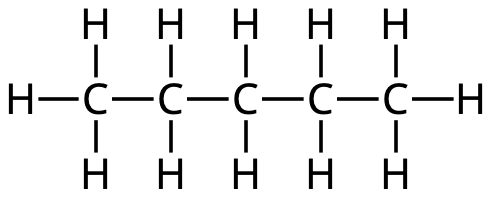
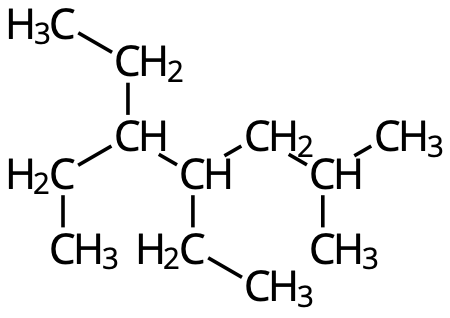
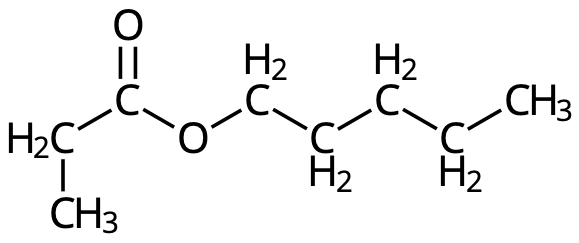
- Namnge följande molekyler: (3p)
Del II. Fullständig lösning och (i förekommande fall) balanserade reaktionsformler krävs.
- Du har 100 ml av två lösningar som vardera har pH = 7,0. Den ena lösningen är destillerat vatten, och den andra är en buffertlösning. Diskutera vad som händer med pH i de båda lösningarna om du tillsätter några ml (a) syra eller (b) bas! (3p)
- Du vill framställa butanal genom oxidation av en alkohol.
- Vilken alkohol skall du utgå ifrån? Ange dess rationella namn! (1p)
- Skriv reaktionsformel med strukturformler för reaktionen! (2p)
- Vid förbränning av glukos bildas koldioxid och vatten. Skriv balanserad formel för reaktionen! (2p)
- Aminoetan är en basisk förening där ett väte i etan bytts ut mot en aminogrupp, -NH2. Skriv formeln (med strukturformler!) för aminoetans protolys i vatten! (2p)
- Du mäter upp 1,000 cm3 saltsyra med pH = 1,6021 och häller i ett provrör. Till detta sätter du 0,03000 g magnesium. Skriv balanserad reaktionsformel för den reaktion som sker, och beräkna pH i lösningen efter reaktion! Saltsyran är fullständigt protolyserad vid denna koncentration. (5p)