Tid: 75 minuter
- Tillåtna hjälpmedel är penna, suddgummi och linjal, formelsamling, samt miniräknare.
- Alla svar ska skrivas på ett annat papper. Detta papper kan du behålla om du vill.
- Alla reaktionsformler skall vara balanserade med minsta möjliga heltalskoefficienter.
- Antalet poäng per uppgift ges på formen (G/VG/MVG). Exempel: Intill en fråga står det ”(1/1/0)”. Det betyder att man kan få maximalt 1 G-poäng och 1 VG-poäng.
Del I. Endast svar behöver anges. Glöm inte enhet!
- I ett lufttätt kärl har jämvikten
N2O4(g)
⇌
2NO2(g)
∆H > 0 för reaktionen åt höger
färglös rödbrun
fått ställa in sig. Dikvävetetraoxiden, N2O4, är färglös, medan kvävedioxiden, NO2, är rödbrun.- Ställ upp jämviktsekvationen för reaktionen. (1/0/0)
- Vad händer med gasblandningens färg om man tillsätter mer N2O4? (1/0/0)
- Vad händer med gasblandningens färg om man ökar trycket i kärlet? (0/1/0)
- Vad händer med gasblandningens färg om man minskar temperaturen på reaktionsblandningen? (0/1/0)
- Vilket pH har en lösning
- som består av 0,250 mol/dm3 salpetersyra, HNO3? (1/0/0)
- där [OH–] = 0,025 mol/dm3? (0/1/0)
- Vid 45 °C är vattnets jonprodukt Kw = 4,0·10-14 M2. Vilket pH har rent vatten vid 45 °C? (0/1/0)
- 2,0
- 6,7
- 7,0
- 7,3
- 13,4
- 14,0
Del II. Fullständiga lösningar ska redovisas. Glöm inte enhet!
- Vid 700 °C mätte man halten SO3, NO, SO2 och NO2 i ett lufttätt reaktionskärl där följande jämvikt ställt in sig:
SO2(g) + NO2(g) ⇌ SO3(g) + NO(g)
De värden man fick var: [SO2] = 0,12 M; [NO2] = 0,18 M; [SO3] = 0,32 M; [NO] = 0,11 M. Vilket värde hade jämviktskonstanten K? (1/0/0) - Man löser lite dinatriumvätefosfat, Na2HPO4 i vatten. Vilken reaktion får lösningen: Sur, neutral eller basisk? Motivera ditt svar. (1/1/0)
- Vid 25 °C är jämviktskonstanten K = 0,46 för nedanstående reaktion:
2BrCl ⇌ Br2 + Cl2
Vid ett visst tillfälle är [BrCl] = 0,30 M; [Br2] = 0,15 M och [Cl2] = 0,15 M.- Visa att systemet inte är i jämvikt (1/0/0)
- Åt vilket håll kommer reaktionen att gå? Motivera ditt svar! (1/1/0)
- Du tillverkar en buffert genom att blanda 25,0 ml 0,100 M NH3 med 75,0 ml 0,250 M NH4Cl. Beräkna buffertens pH. (1/1/0)
- Du har 0,250 dm3 av en lösning med 1,50 M ättiksyra. Vilket är lösningens pH? (2/2/0)
- Polyakrylamid, [-CH2-CH(C(O)NH2)-]n, är en polymer av akrylamid, CH2CHC(O)NH2. Det betyder att polyakrylamid är ett stort ämne som är uppbyggt av många små akrylamid-rester. Polyakrylamid är helt ofarligt, medan akrylamid är giftigt och kan skada nervsystemet allvarligt.
När man tillverkar polyakrylamid kan det göras enligt följande kemiska reaktionsformel:
nCH2CHC(O)NH2 ⇌ [-CH2-CH(C(O)NH2)-]n
Eller, med strukturformler:
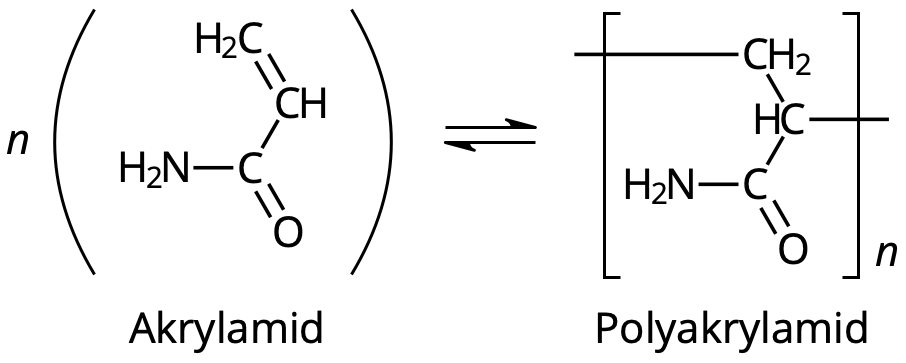
Reaktionen är en jämvikt som är starkt förskjuten åt höger.
Det kan vara en riktigt dum idé att försöka täta väggarna i tunneln genom Hallandsåsen med polyakrylamid. Använd både kemiska argument, beräkningar och ekologiska argument för att förklara varför! (2/2/2)
Facit
Betygsgränser
| Max: | 25 | 12/11/2 |
| Medel: | 14,2 | 8,9/5,1/0,19 |
| G: | 8,0 | |
| VG: | 14,5 | varav minst 5,5 VGp eller MVGp |
| MVG: | 20,0 | varav minst 8,5 VGp och 1 MVGp |
Del I. Endast svar krävs.
Ingen/felaktig enhet i svaret … -1p
Räknat med avrundade siffror … -0,5p
- \(K = \frac {[\text{NO}_2]^2}{[\text{N}_2\text{O}_4]}\)
- Den blir mer rödbrun
- Den blir mindre rödbrun
- Den blir mindre rödbrun
- pH = 0,60
- pH = 12,40
- b)
Lösning: I rent vatten (neutralt) är [H+] = [OH–]. Eftersom
Kw = [H+][OH–]
får vi att
\([\text{H}^+] = \sqrt{4,0 \cdot 10^{-14}\text{M}^2} = 0,00000020\text{M}\)
och
\(\text{pH} = -\lg{[\text{H}^+]} = -\lg0,00000020 = 6,698970004 \approx 6,70\)
Del II. Frågor som kräver fullständig lösning och (i förekommande fall) balanserade formler. Glöm inte enhet!
- \(K = \frac {[\text{SO}_3\text{(g)}][\text{NO}\text{(g)}]}{[\text{SO}_2\text{(g)}][\text{NO}_2\text{(g)}]} = 1,62962963 \approx 1,6\)
-
\(K_{\text{a, HPO}_4^{2-}} = 4,4 \cdot 10^{-13}\text{M}\)
\(K_{\text{b, HPO}_4^{2-}} = 1,6 \cdot 10^{-7}\text{M}\)
\(K_{\text{a, HPO}_4^{2-}} < K_{\text{b, HPO}_4^{2-}}\) … (1/0/0)
Eftersom \({\sf \text{HPO}_4^{2-}}\) är en mycket svag syra (och måttligt stark bas) blir lösningen basisk. … (0/1/0)
-
\(Q = \frac {[\text{Br}_2][\text{Cl}_2]}{[\text{BrCl}]^2} = \frac {0,15\text{M} \cdot 0,15\text{M}}{0,30\text{M}^2} = 0,25\)
Eftersom \(Q \neq K\) är systemet inte i jämvikt.
-
Om \(Q\) ska närma sig \(K\), måste \(Q\) bli större. Det kan det bara bli om [Br2] och [Cl2] ökar, samtidigt som [BrCl] minskar. Därför kommer reaktionen att gå åt höger.
-
-
Buffertformeln ger att
\(\text{pH} = \text{p}K_{\text{a}} - \log \left(\frac {c_{\text{syra}}}{c_{\text{bas}}} \right )\)
\(c_{\text{syra}} = \frac {75\text{ml} \cdot 0,250\text{M}}{(25+75)\text{ml}} = 0,1875\text{M}\)
\(c_{\text{bas}} = \frac {25\text{ml} \cdot 0,100\text{M}}{(25+75)\text{ml}} = 0,0250\text{M}\)
\(\text{p}K_{\text{a, NH}_4^+} = 9,25\) (från tabell) … (0/1/0)
\(\text{pH} = 9,25 - \log \left(\frac {0,1875}{0,0250} \right ) = 8,37493874 \approx 8,37\)… (1/0/0)
-
HAc ⇌ H+ + Ac–
HAc
H+
Ac–
f.r.
1,50 M
0
0
Δ
-x
+x
+x
v.j.
(1,50 - x)M
xM
xM
\(K_{\text{a}} = \frac {[\text{H}^+][\text{Ac}^-]}{[\text{HAc}]}\) … (1/0/0)
\(K_{\text{a}} = 10^{-4,75}\text{M}\) (från tabell)
\(10^{-4,75} = \frac {x^2}{1,50 - x} \approx \frac {x^2}{1,50}\)
\(10^{-4,75} \cdot 1,50 = x^2\)
\(x = \sqrt{10^{-4,75} \cdot 1,50} = 0,0051647063 = [\text{H}^+]\) … (0/1/0)
Eftersom x << 1,50 går det bra att försumma x bredvid 1,50. … (0/1/0)
pH = –log[H+] = –log0,0051647063 = 2,28695437 ≈ 2,29 … (1/0/0)
-
Eleven tar upp antingen kemiska argument, beräkningar eller ekologiska argument, och diskuterar dessa översiktligt. (1-2/0/0)
Eleven tar upp åtminstone två av kemiska argument, beräkningar och ekologiska ar-gument, och diskuterar dessa utförligt (1-2/1-2/0)
Eleven tar upp både kemiska argument, beräkningar och ekologiska argument, och diskuterar dessa utförligt och nyanserat. (1-2/1-2/1-2)