Videogenomgång (flippat klassrum)
English-speaking or IB student? Check out the English version instead!
 Hur relaterar detta till kursmålen i Kemi 1?
Hur relaterar detta till kursmålen i Kemi 1?
Såhär står det i skolverkets kursmål för Kemi 1:
Undervisningen i kursen ska behandla följande centrala innehåll:
Modeller och teorier för materiens uppbyggnad och klassificering.
Detta kan man bl.a. tolka till att eleven skall lära sig om lära sig hur periodiska systemet är uppbyggt.
Varför har man ett periodiskt system?
Dmitrij Mendelejev
Mitten av 1800-talet: Ungefär 60 grundämnen upptäckta.
Dmitrij Mendelejev ordnar grundämnena efter stigande atommassa.
- Upptäcker att vissa egenskaper återkommer med viss periodicitet!
Ämnen med likartade egenskaper placerades i samma grupp.
Det fina med Mendelejevs system
Mendelejev lämnade vissa luckor!
- Detta, förutspådde Mendelejev, var grundämnen som ännu inte upptäckts.
En bra vetenskaplig teori måste kunna göra förutsägelser om framtiden (prediktion)!
- Det visade sig att Mendelejevs förutsägelser var mycket exakta!
Antalet protoner = Atomnummer ⇒ Ordningsföljd
Mendelejev ordnade ursprungligen atomerna efter atommassa.
När man kunde bestämma antalet protoner i en atom, såg man att detta till stor del stämde överens med atommassan.
Antalet protoner fick då bestämma vilket atomnummer ett visst atomslag hade, och därmed också ordningsföljden.
Elektronerna ordnas så att de får lägsta möjliga energi
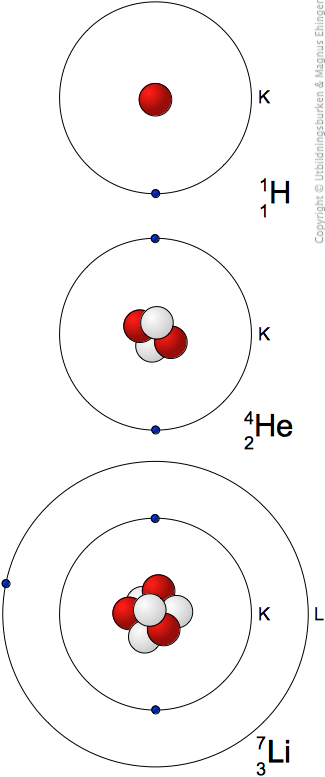
Väte
- Atomnummer: 1
- Masstal: 1
- Antalet protoner i kärnan: 1
- Antalet neutroner i kärnan: 0
- Antalet elektroner runt kärnan: 1
Nästa grundämne: Helium
- Atomnummer: 2
- Masstal: 4
- Antalet protoner i kärnan: 2
- Antalet neutroner i kärnan: 2
- Antalet elektroner runt kärnan: 2
K-skalet ganska litet ⇒ redan efter två elektroner är det fullt, och det får inte plats fler!
Litium
- Atomnummer: 3
- Masstal: 7
- Antalet protoner i kärnan: 3
- Antalet neutroner i kärnan: 4
- Antalet elektroner runt kärnan: 3
Nu börjar vi fylla på L-skalet!
Elektronerna i det yttersta skalet avgör mycket av ett ämnes kemiska egenskaper.
Elektronerna i det yttersta skalet kallas valenselektroner.
Antalet elektroner som maximalt får plats i ett skal: 2n2, där n är skalnumret, räknat inifrån.
| Skal | n | 1 (K) | 2 (L) | 3 (M) | 4 (N) |
| Maximalt antal e– | 2n2 | 2 | 8 | 18 | 32 |
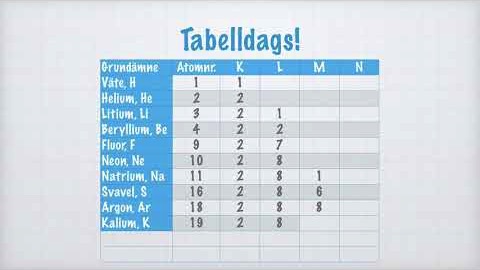
Dags för en liten tabell! 😊
| Grundämne | Atomnr. | K | L | M | N |
| Väte, H | 1 | 1 | |||
| Helium, He | 2 | 2 | |||
| Litium, Li | 3 | 2 | 1 | ||
| Beryllium, Be | 4 | 2 | 2 | ||
| Fluor, F | 9 | 2 | 7 | ||
| Neon, Ne | 10 | 2 | 8 | ||
| Natrium, Na | 11 | 2 | 8 | 1 | |
| Svavel, S | 16 | 2 | 8 | 6 | |
| Argon, Ar | 18 | 2 | 8 | 8 | |
| Kalium, K | 19 | 2 | 8 | 8 | 1 |
| Zink, Zn | 30 | 2 | 8 | 18 | 2 |
| Krypton, Kr | 36 | 2 | 8 | 18 | 8 |
I tabellen ovan är valenselektronerna i blå fetstil.
Exempel: Ange elektronkonfigurationen för syre, 8O
Lösning: Syreatomen har 8p+ och 8e–. Två av elektronerna får plats i K-skalet, resten måste vara i L-skalet.
| K | L | M | |
| 8p+ | 2e– | 6e– | 0 |
Valenselektroner
Valenselektronerna bestämmer mycket av ämnets kemiska egenskaper!
- Ju längre bort från atomkärnan, desto hellre ger de sig iväg!
- Ju färre de är, desto hellre ger de sig iväg!
Skriv elektronformler för de tio första grundämnena.
Skriv elektronformler för ädelgaserna.
- Ädelgaserna har åtta valenselektroner.
- Åtta är särskilt stabilt!
- Ädelgasernas egenskaper liknar varandra – eftersom de har samma antal valenselektroner!
Oktettregeln
Max antal valenselektroner är just åtta (i de flesta fall).
Vid kemiska reaktioner strävar de ingående atomerna efter att få åtta valenselektroner i sitt yttersta skal.
- Detta kallas för oktettregeln!
- Undantag: väte, helium: Maximalt 2 valenselektroner.