Plocka fram
- Kalium (alt. natrium)
- Kristallisationsskål, stor
- Bägare, stor
- Filterpapper
- En bit magnesiumband
- Järnfilspån alt. tomtebloss
- Järnspik
- Tändstickor
- Zinkbleck
- Stort provrör
- 1 M HCl
- 5 M HCl
Varför går olika reaktioner olika fort?
Fyra saker som påverkar reaktionshastigheten:
- Ämnenas inneboende egenskaper
- Temperaturen
- Koncentrationen
- Närvaro av en katalysator
1. Ämnenas inneboende egenskaper
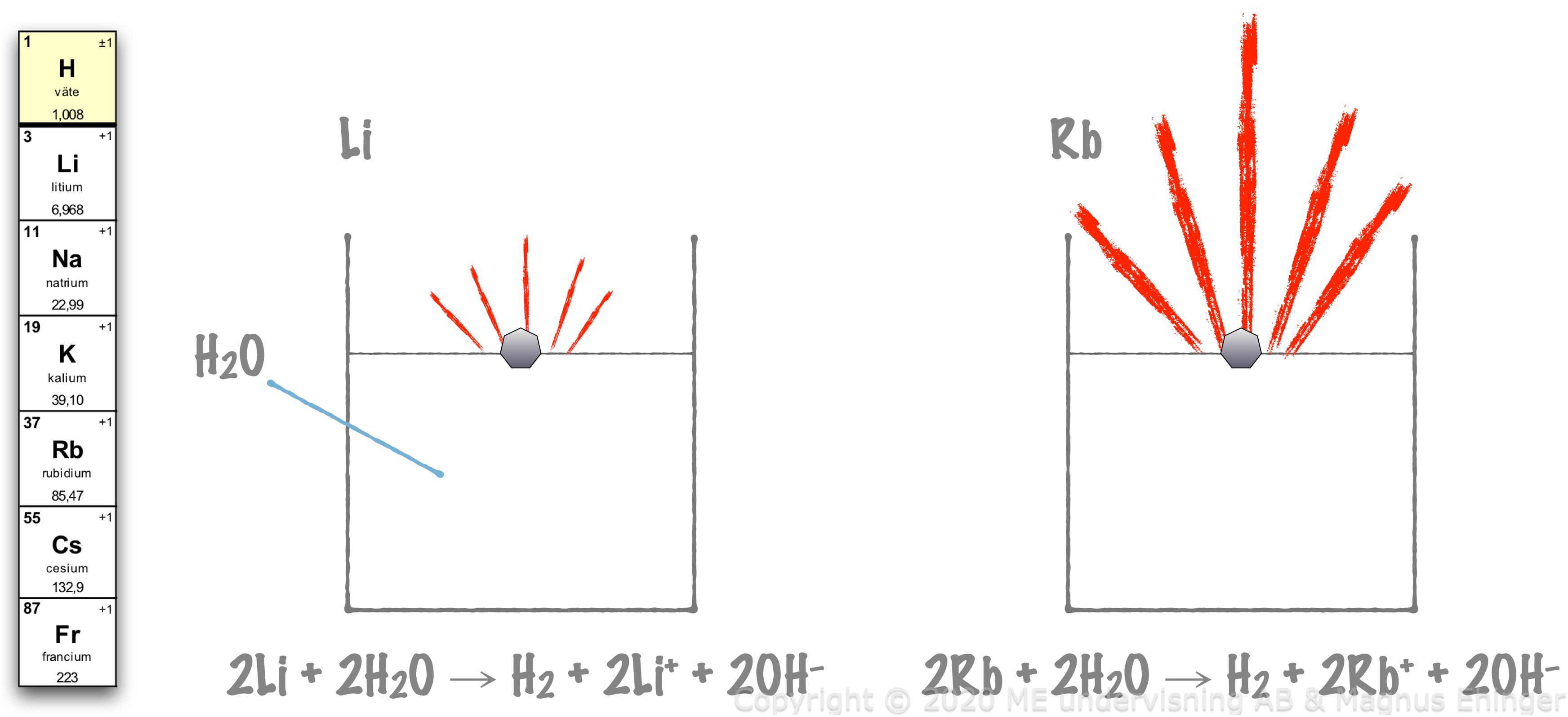
Olika ämnen har olika inneboende egenskaper, vilket gör att de reagerar på olika sätt, och olika kraftigt.
Exempel:
- Olika grundämnen reagerar olika kraftigt på grund av valenselektronernas olika avstånd till atomkärnan.
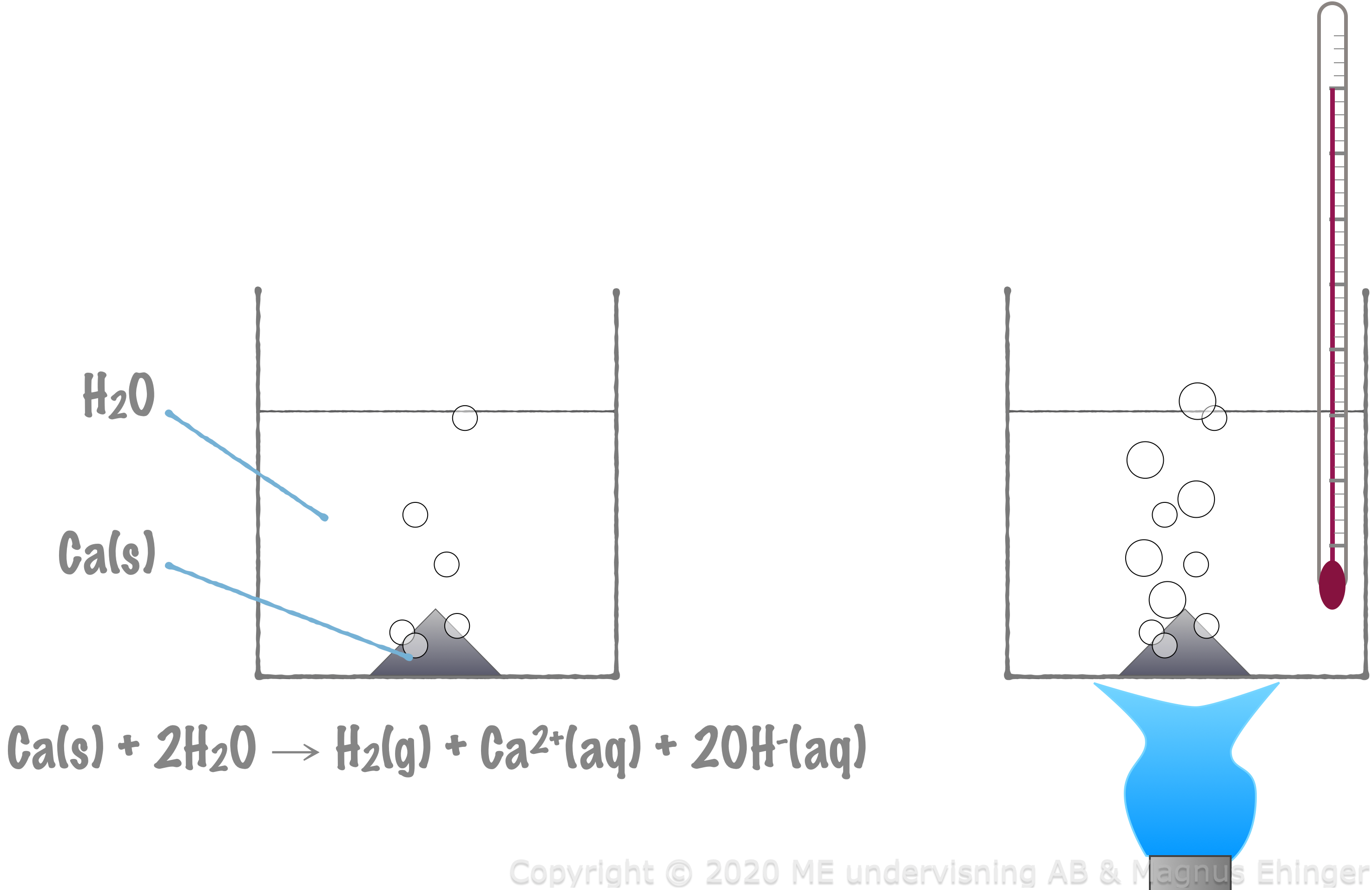
- Finfördelade ämnen har större angreppsyta än kompakta ämnen ⇒ högre reaktionshastighet.
2. Temperatur
Högre temperatur ⇒ högre reaktionshastighet. Varför?
Kollisioner
Atomer/molekyler måste kollidera för att det ska ske en reaktion.
- Alla kollisioner leder dock inte till reaktion!
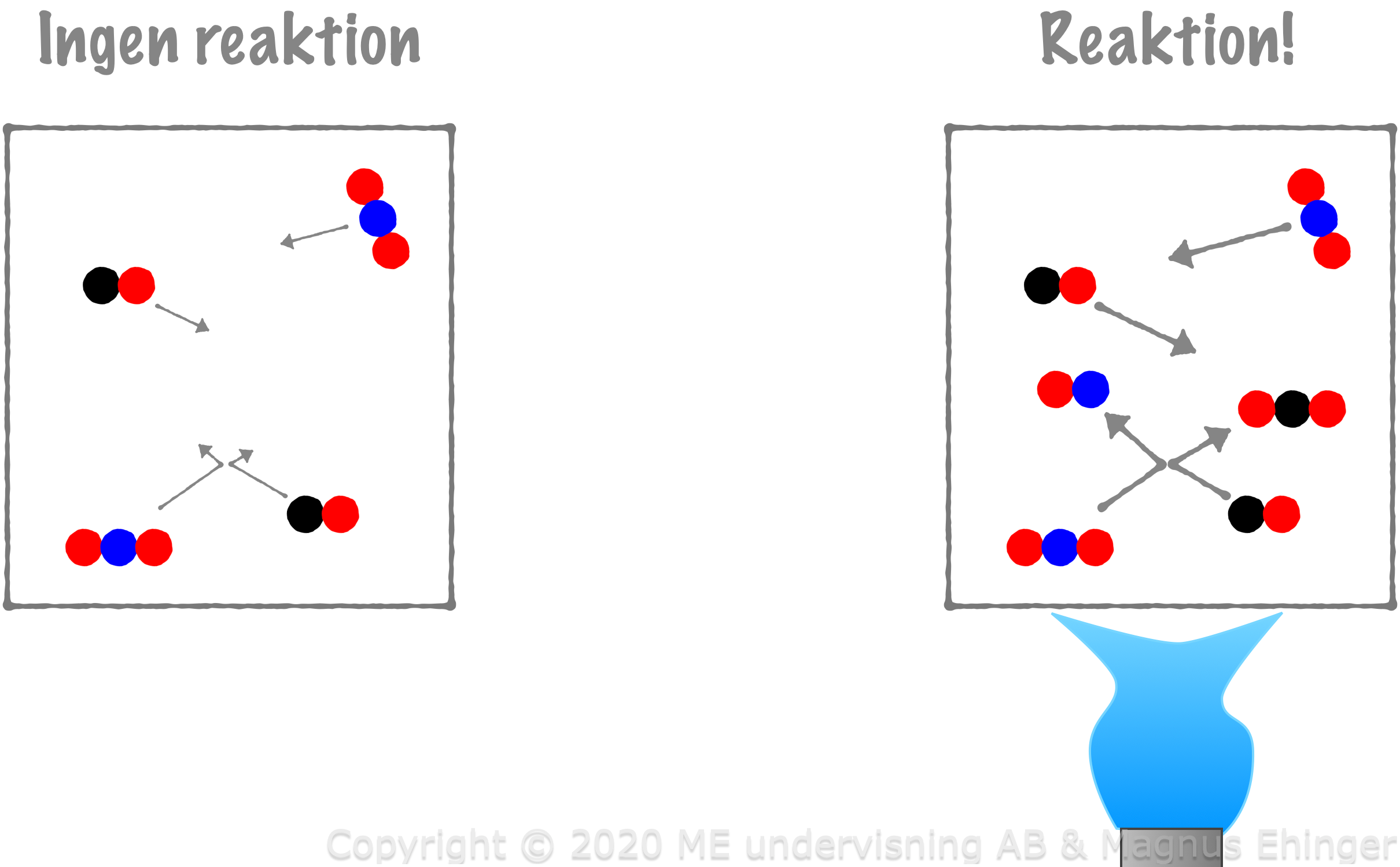
För att det ska ske en reaktion, måste krocken ske
- på rätt sätt, och
- med minst en viss hastighet = en viss energi (temperatur).
Kollisioner måste ske på rätt sätt
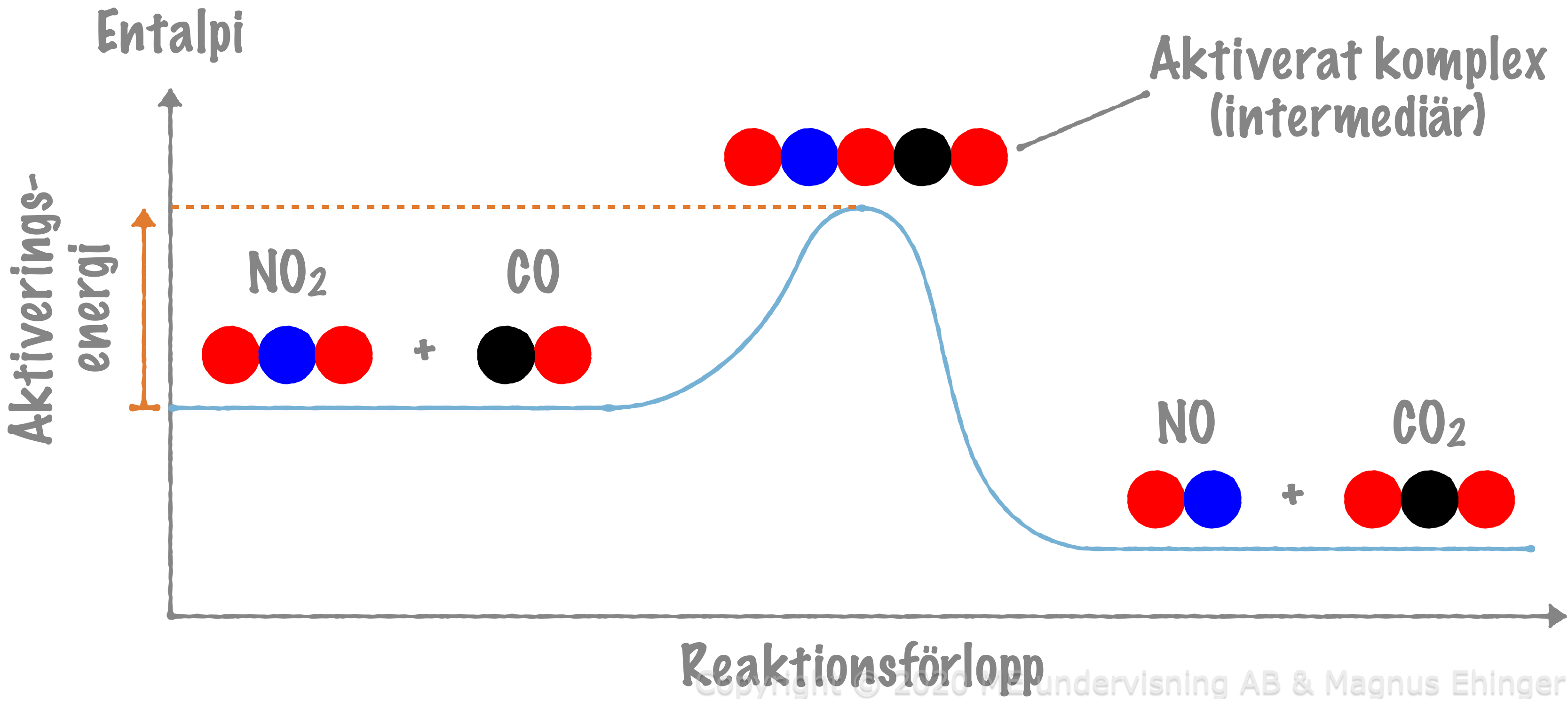
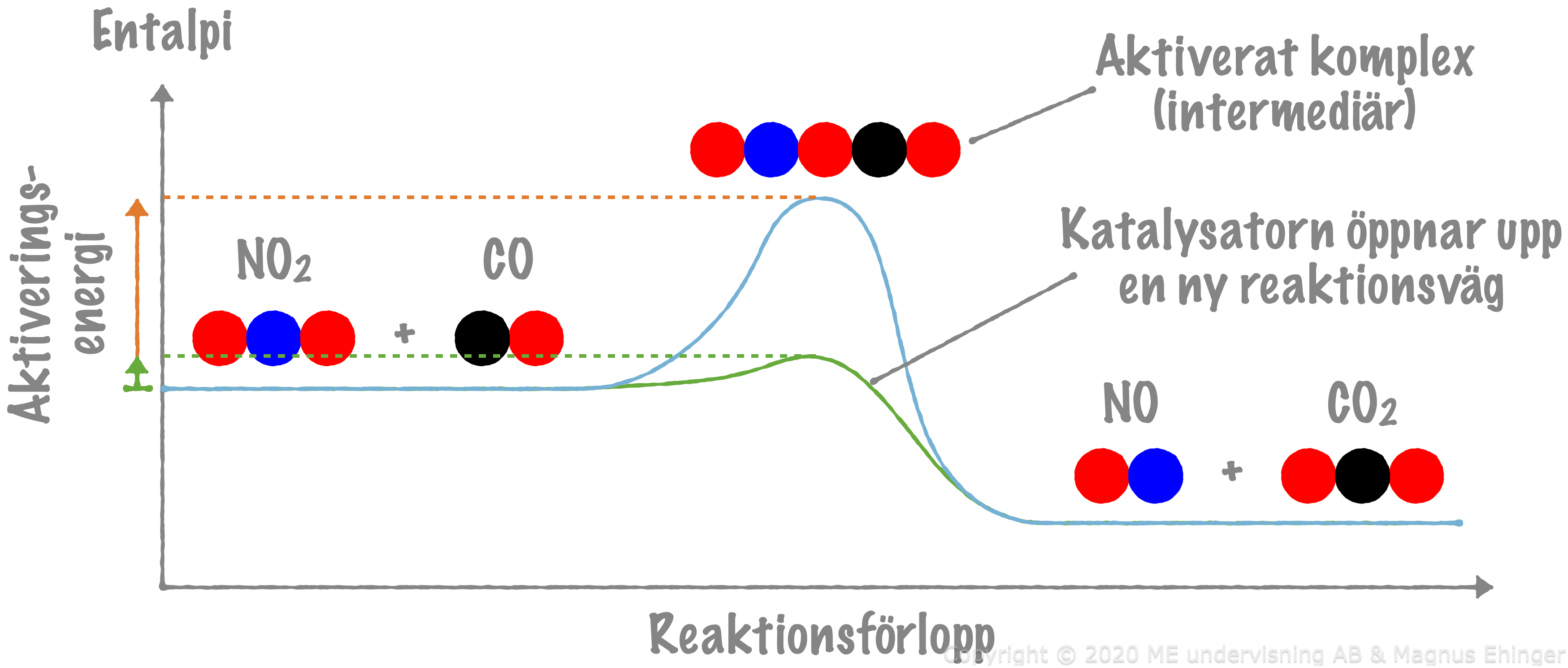
Vi tittar på reaktionen NO2 + CO → NO + CO2.
Kollisioner måste ske med tillräcklig hastighet (energi)
För att det ska kunna ske en reaktion måste molekylerna ha så hög energi att det bildas ett aktiverat komplex.
- Det aktiverade komplexet är en intermediär, det vill säga ett mellansteg, ett ämne som bara existerar en mycket kort stund.
Den mängd energi som krävs för att nå det aktiverade komplexet kallas för reaktionens aktiveringsenergi.
Högre temperatur ⇒ fler energirika kollisioner.
3. Hög koncentration ⇒ fler kollisioner
Temperaturen är ett mått på molekylernas medelhastighet (rörelseenergi).
- Olika molekyler har olika hastighet.
4. Vad gör en katalysator?
Katalysator = ett ämne som påskyndar en viss reaktion utan att själv förbrukas.
Exempel: Väteperoxid sönderfaller spontant till vatten och syrgas
2H2O2 → 2H2O + O2
Långsam reaktion!
Tillsätt kaliumjodid → reaktionen går mycket snabbare!
En katalysator ökar reaktionshastigheten
Vad händer med kaliumjodiden (katalysatorn)?
- Ingenting!
Hur kan detta vara?
- Vi ska titta på detta lite grann, längre fram
- Vi ska titta ännu närmare på det i avsnittet om enzymer.
Viktiga katalysatorer
Avgasrenare:
- 2CO + 2NO → 2CO2 + N2
- Rh och Pt på keramiskt material
Enzymer:
- Enzymer är cellens katalysatorer
- Enzymer är proteiner.
- Närapå alla uppbyggande och nedbrytande funktioner i cellen styrs av enzymer.
Katalysatorn får bara reaktionen att gå snabbare
Termodynamiskt ofördelaktiga reaktioner kan inte åstadkommas med hjälp av katalysatorer!