Videogenomgång (flippat klassrum)
English-speaking or IB student? Check out the English version instead!
 Klorgas reagerar med natrium
Klorgas reagerar med natrium
Innan vi går in på det periodiska systemet och grundämnena i det är det två begrepp du måste få lite koll på: Oxidation och reduktion. För att göra det kollar vi på reaktionen mellan klorgas och natrium.
Reaktionsformel:
2Na + Cl2 → 2NaCl
Men vad är det egentligen som händer?
Redoxreaktioner
Ordformel:
- natrium + klorgas → natriumklorid + energi
Elektronformler:
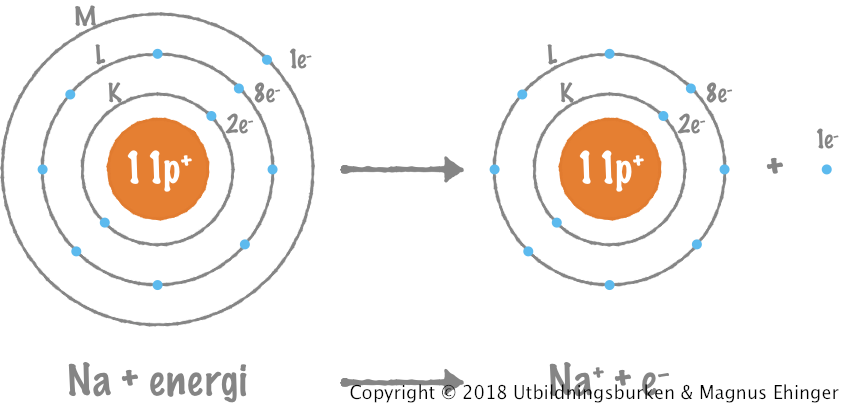
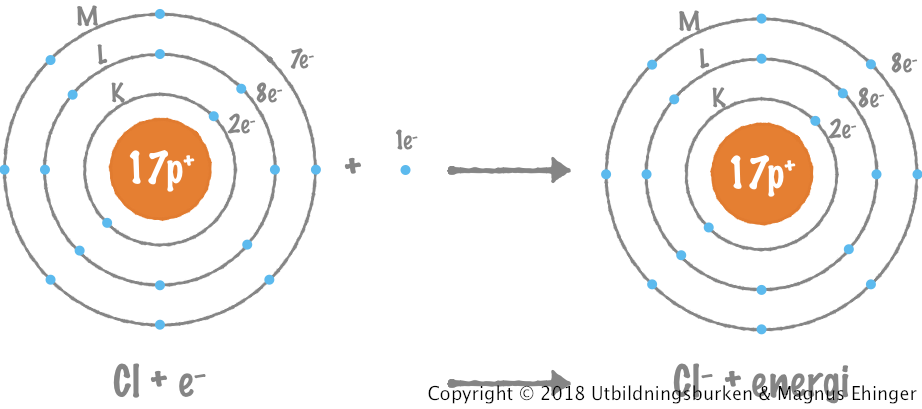
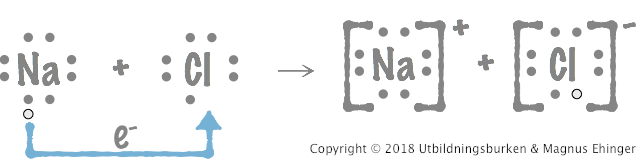 När natrium reagerar med klor avger varje natriumatom en elektron till varje kloratom.
När natrium reagerar med klor avger varje natriumatom en elektron till varje kloratom.
Elektronkonfigurationer:
| Na | K | L | M | + | Cl | K | L | M | → | Na+ | K | L | M | + | Cl– | K | L | M |
| 11p+ | 2e– | 8e– | 1e– | 17p+ | 2e– | 8e– | 7e– | 11p+ | 2e– | 8e– | 0e– | 17p+ | 2e– | 8e– | 8e– |
Oxidation, reduktion och redox-reaktion
Redoxreaktion = oxidation + reduktion
| Oxidation: | 2Na → 2Na+ + 2e– | (×2) | |
| + | Reduktion: | Cl2 + 2e– → 2Cl– | |
| Redox: | 2Na + Cl2 → 2NaCl | ||