En klassiker: En droppe bläck i en kristallisationsskål. Vad händer?
- Även utan omrörning diffunderar bläcket ut i lösningen!
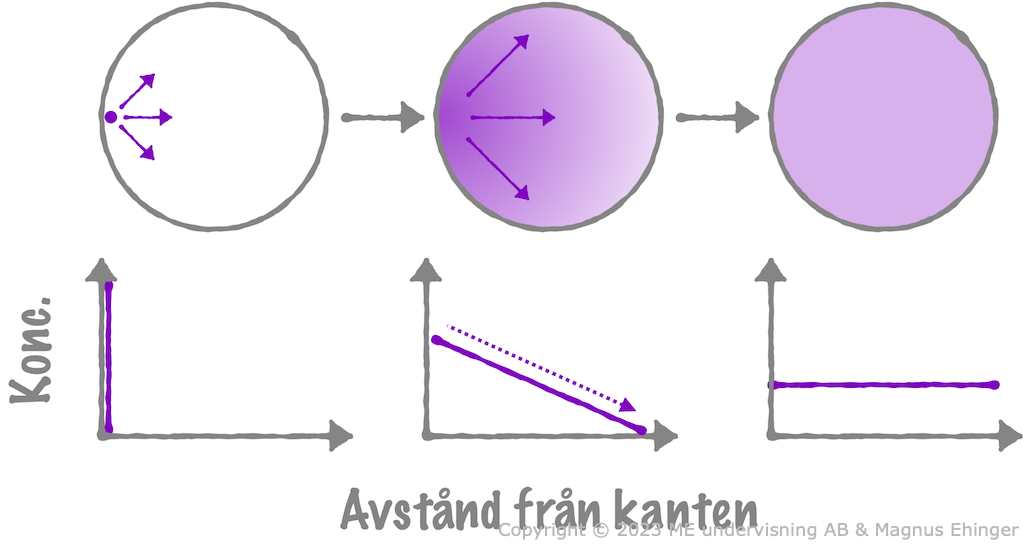
Diffusion är när ett ämne rör sig från ett område med hög koncentration till ett område med lägre koncentration tills ämnet är helt jämnt fördelat.
Koncentrationsgradient
Det bildas en koncentrationsgradient:
- En jämnt avtagande koncentration från området med högre koncentration till området med lägre.
- Det diffunderande ämnet rör sig längs sin koncentrationsgradient.
Passiv transport över cellmembranet
Släpps inte igenom: Joner och polära molekyler.
- Exempel: Na+, H2O.
- Vatten transporteras via särskilda transportproteiner, så kallade aquaporiner.
Transportproteiner
Hur ska cellen få in viktiga ämnen, såsom salter och socker, i sig?
- Membranbundna proteiner sköter transporten över cellmembranet.
Passiv transport: Diffusion längs med koncentrationsgradienten.
- Porer (kanalproteiner) – Icke selektiva.
- Selektiva transportörer.
- Släpper endast igenom en viss typ av molekyler.
Aktiv transport: Mot koncentrationsgradienten.
- Pumpar.
- Selektiva.
- Kräver energi, oftast i form av ATP.
Vattnets diffusion
Vatten diffunderar genom s.k. aquaporiner.
- Selektiva transportörer.
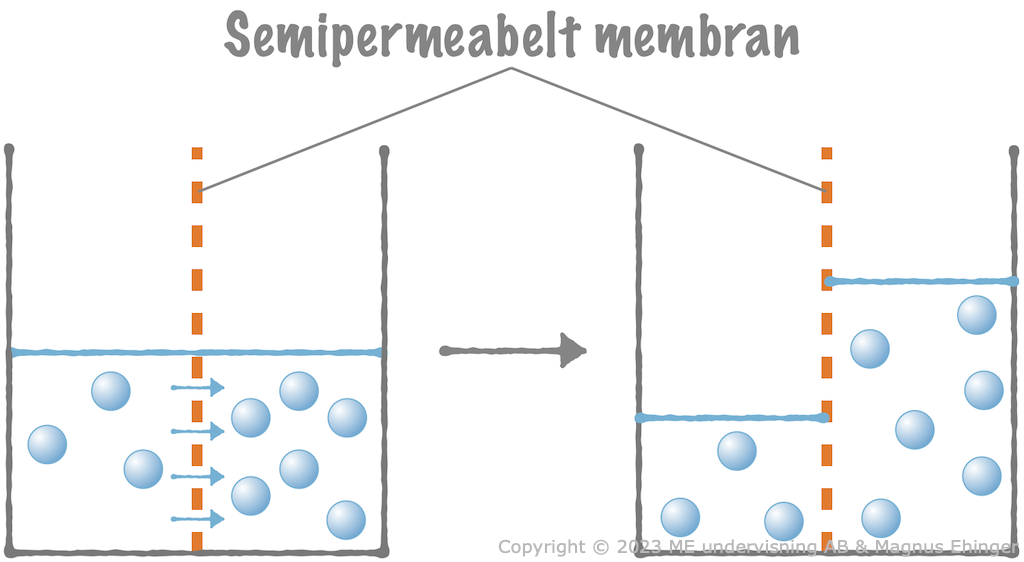
Vattnets diffusion över ett membran kallas osmos.
Osmos
Ett ämne vill gå från ett ställe med hög koncentration, till ett ställe med låg koncentration (med koncentrationsgradienten).
- Detta gäller även vatten!
(Därför diffunderar vatten in i sektionen med bläck i experimentet överst, medan bläcket diffunderar ut i lösningen!)
Även andra faktorer påverkar vattnets osmos. Här förenklar vi dock rätt mycket för att få en modell som är lättare att förstå.
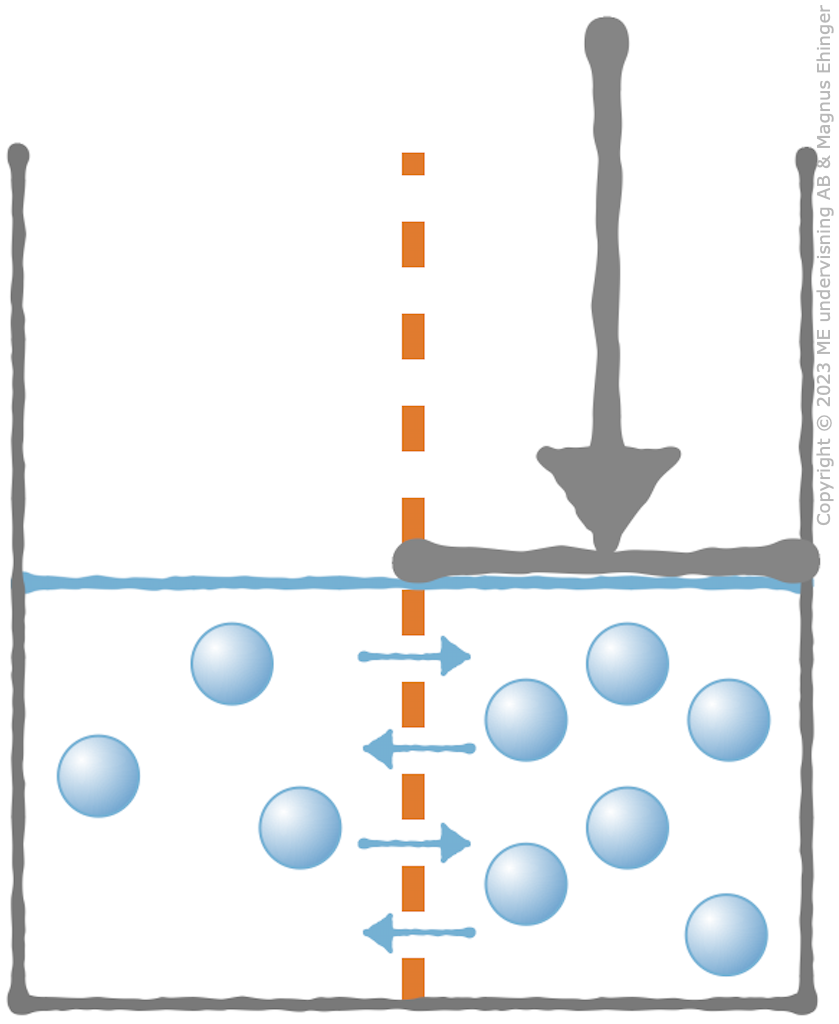
Osmotiskt tryck
- Det tryck man måste lägga på för att hindra vattnet från att diffundera.
- Ju större skillnad i vattenkoncentration, desto större osmotiskt tryck.
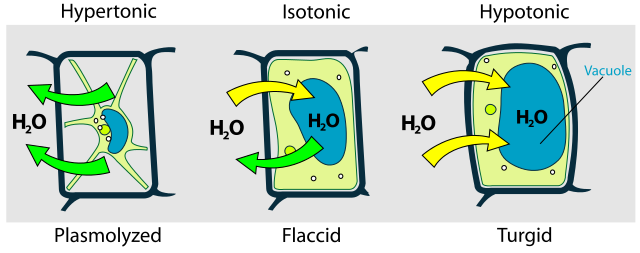
Hyper-, iso- och hypotona lösningar
Vad händer med en cell i hypoton, isoton och hyperton lösning?
- Hypoton = lägre saltkoncentration, ex. destillerat vatten
- Isoton = samma saltkoncentration, 0,9 % NaCl
- Hyperton = högre saltkoncentration, ex. 3 % NaCl
En djurcell i hypoton lösning spricker (lyseras). En växtcell klarar sig tack vare cellväggen som håller emot. I hypertona lösningar kommer båda celltyperna att skrumpna, då vatten flyter ut ur cellen.