Först, lite termodynamik
Enligt termodynamikens andra (?) lag, strävar ett system alltid efter att ha så låg fri energi som möjligt.
För varje bindning som uppstår mellan två atomer, frigörs det energi
- När det uppstår kovalenta bindningar, frigörs det i storleksordningen 200-460 kJ.
- När det uppstår vätebindningar och van der Waals-bindningar (svaga interaktioner), frigörs det i storleksordningen 4-30 kJ.
I ett protein finns det många svaga interaktioner. Då blir den frigjorda energin maximal.
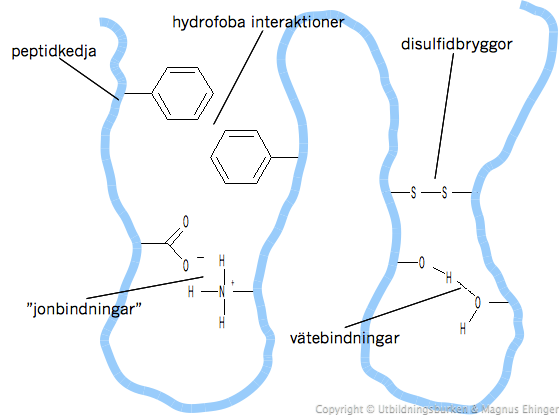
Bindningar inuti proteinet
Disulfidbryggor är starka bindningar, som håller samman proteinet
Andra (svaga) intermolekylära bindningar som håller ihop proteinet:
- Hydrofoba interaktioner (van der Waals-bindningar)
- "Jonbindningar" mellan positivt och negativt laddade sidokedjor på aminosyrorna
- Vätebindningar, som t.ex. i α-helixar och β-plattor.
Vattenlösligt eller fettlösligt?
Kommer du ihåg från Kemi 1: "Lika löser lika"?
Ett protein är mycket olikt en vattenmolekyl. Hur kan då proteiner vara vattenlösliga?
- För att ett ämne ska kunna lösa sig i ett lösningsmedel, måste det kunna uppstå bindningar mellan ämnet och lösningsmedlet
För att ett protein skall vara vattenlösligt, måste det också binda med vätebindningar till vattnet
- Detta gör att hydrofila och starkt polära aminosyror gärna finns på ytan av proteinet
- Hydrofoba aminosyror hittar vi inuti proteinet
Om en ensam, polär aminosyra finns inuti ett protein, destabiliseras proteinet, om det inte finns en annan aminosyra den kan binda med vätebindning/dipolbindning till.
- Om det sker en mutation som gör att en opolär aminosyra inne i ett protein byts ut mot en polär aminosyra, kommer proteinets struktur förändras.
- Om proteinet struktur förändras, förändras (eller försvinner) också dess funktion!
Proteiner som inte är vattenlösliga, och membranbundna proteiner, behöver inte alltid ha hydrofila aminosyror på proteinytan
- Membran består ju av fetter (egentligen fosfolipider), och därmed hydrofoba.