Videogenomgång (flippat klassrum)
English-speaking or IB student? Check out the English version instead!
Exoterma reaktioner
Vad händer om man förbränner vätgas i syrgas?
- Reaktionsformel: 2H2(s) + O2(g) → 2H2O(g) + energi Vi vet av erfarenhet att
- vätgasen och syrgasen omvandlas till vatten; och
- det blir varmt
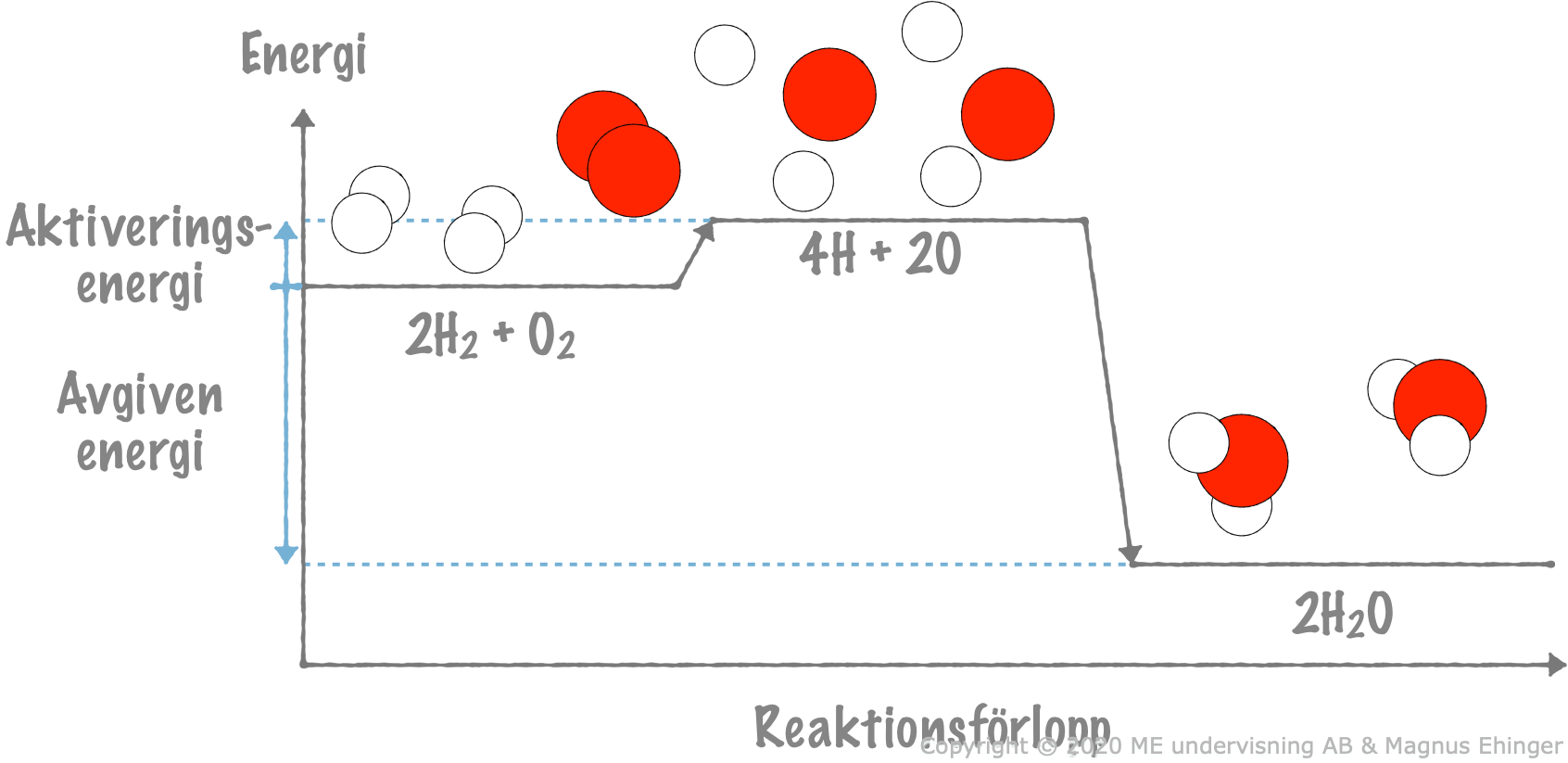 Energiförändringar när väte reagerar med syre och bildar vatten.
Energiförändringar när väte reagerar med syre och bildar vatten.
Först måste man bryta bindningarna mellan väteatomerna. Detta kräver tillförsel av energi. Denna energimängd kallas aktiveringsenergi.
- Sedan måste man bryta bindningarna mellan syreatomerna. Detta kräver också tillförsel av energi.
- Slutligen bildas nya bindningar mellan väte och syre. Då frigörs energi.
När bindningarna i vatten bildas, frigörs sammanlagt mera energi än vad som tillförs för att bryta bindnigarna mellan kolatomerna och mellan syreatomerna. Därför avges det värme vid reaktionen.
- Reaktionen kallas exoterm (av gr. exo = ut och lat. term = värme).
- Den sammanlagda (kemiska) energin hos produkterna är lägre än hos reaktanterna.
Endoterma reaktioner
Vad händer under fotosyntesen?
Reaktionsformel: 6CO2 + 6H2O + energi → C6H12O6 + 6O2
 I fotosyntesen tas det totalt upp mer energi än vad som avges.
I fotosyntesen tas det totalt upp mer energi än vad som avges.
För att reaktionen skall ske, måste det hela tiden tillföras energi.
- (Förvisso frigörs det energi när det bildas nya bindningar i sockermolekylen, men den energi som frigörs är mindre än den energi som måste tillsättas för att bryta bindningarna i koldioxiden och i vattnet.)
Reaktionen kallas endoterm (av gr. endo = in).
- Den sammanlagda (kemiska) energin hos produkterna är högre än hos reaktanterna.
Två skojiga reaktioner
Natriumhydroxid löses i vatten
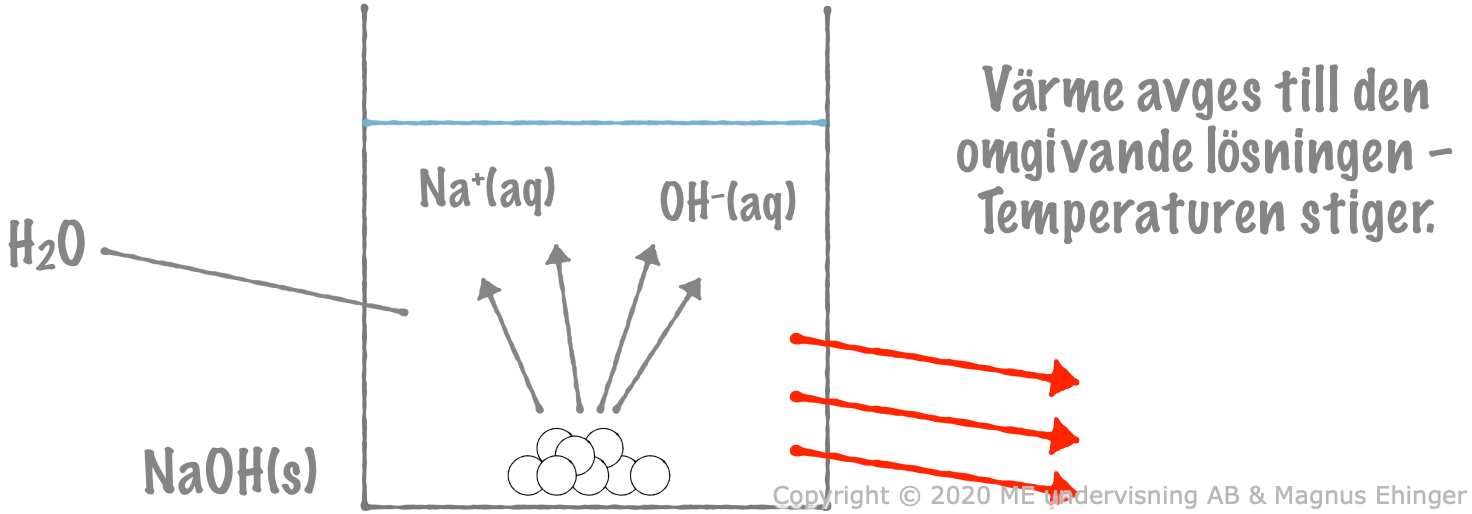 När natriumhydroxid löses i vatten avges värmeenergi till omgivningen, och omgivningens temperatur stiger.
När natriumhydroxid löses i vatten avges värmeenergi till omgivningen, och omgivningens temperatur stiger.
Reaktionsformel:
\(\text{NaOH(s)} \xrightarrow{\text{ H}_2\text{O }} \text{Na}^+\text{(aq)} + \text{OH}^-\text{(aq)}\)
- Först bryts jonbindningarna mellan natrium- och hydroxidjonerna. Detta kräver tillförsel av energi.
- Sedan bildas nya bindningar mellan jonerna och vattnet.
Fråga
Vilken typ av bindning uppstår?Svar
Jon-dipolbindningar!
Då frigörs energi i form av värme.
- Fråga eleverna, vilken energimängd är störst, den som tillförs eller den som frigörs, vid just denna reaktion?
 Hur energin förändras när fast natriumhydroxid löses i vatten.
Hur energin förändras när fast natriumhydroxid löses i vatten.
Observera: Produkterna, Na+(aq) och OH–(aq), har lägre energi än reaktanten, NaOH(s).
Ammoniumnitrat löses i vatten
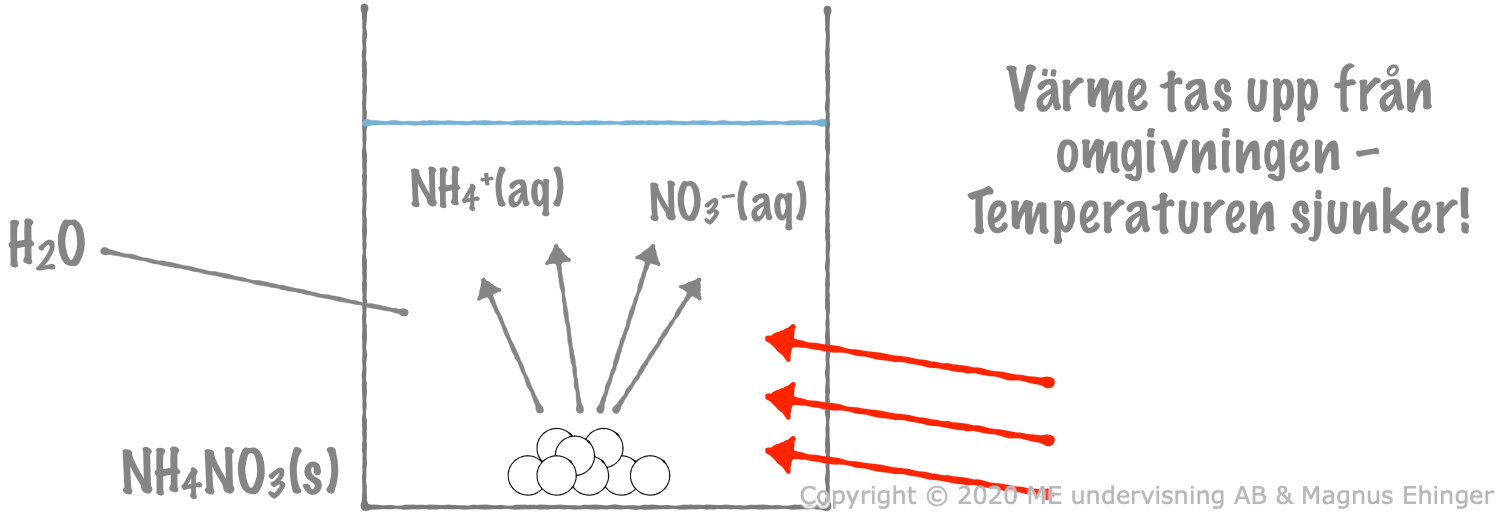 När ammoniumnitrat löses i vatten tas det upp värmeenergi från omgivningen, och omgivningens temperatur sjunker.
När ammoniumnitrat löses i vatten tas det upp värmeenergi från omgivningen, och omgivningens temperatur sjunker.
Reaktionsformel:
\(\text{NH}_4\text{NO}_3\text{(s)} \xrightarrow{\text{ H}_2\text{O }} \text{NH}_4^+\text{(aq)} + \text{NO}_3^-\text{(aq)}\)
Temperaturen i bägaren sjunker! Fråga eleverna, vad betyder detta med avseende på
- den energi som krävs för att bryta jonbindningarna mellan ammoniumjonerna och nitratjonerna?
- den energi som frigörs när jonerna hydratiseras?
- vilken energimängd av de två som är störst?
Fråga
Är reaktionen endoterm eller exoterm reaktion?
Svar
Endoterm!
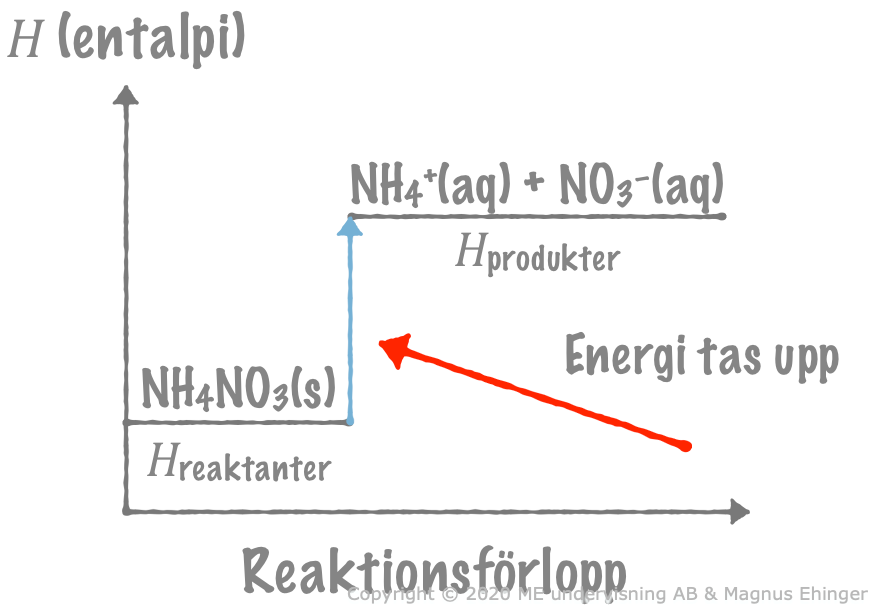
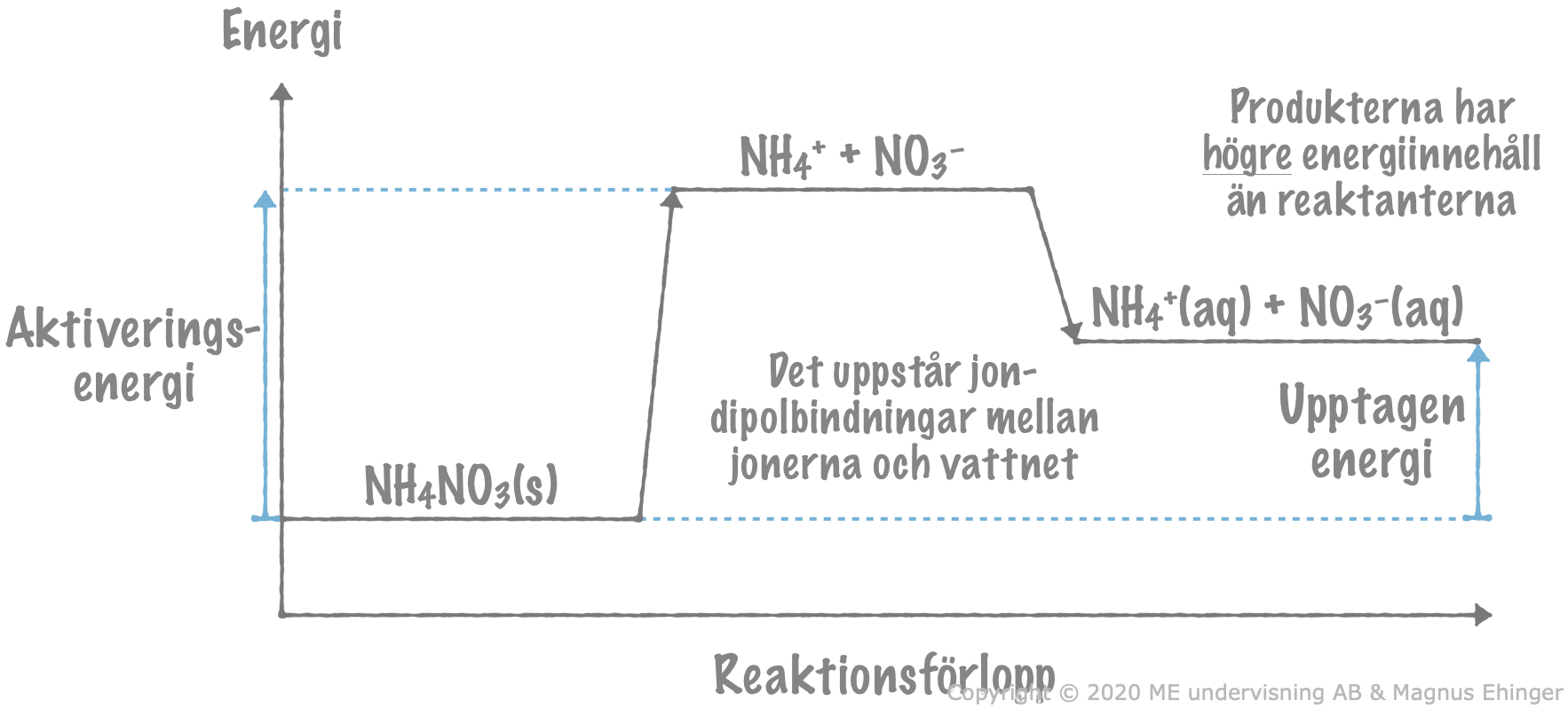 Hur energin förändras när fast ammoniumnitrat löses i vatten.
Hur energin förändras när fast ammoniumnitrat löses i vatten.
Observera: Produkterna, NH\(_4^+(aq)\) och NO\(_3^-(aq)\), har högre energi än reaktanten, NH4NO3(s).
Entalpi
Ett ämnes energiinnehåll (värmeinnehåll) kallas dess entalpi.
- Tecknas \(H\), enhet J(oule) (och ibland J/mol)
Vid en reaktion ändras entalpin för de ingående ämnena. Ändringen betecknas \(\Delta H\), och den är lika med \(H_{\text{produkter}}-H_{\text{reaktanter}}\).
Exempel
1 mol kol reagerar med 1 mol syrgas, och bildar koldioxid.
- C(s) + O2(g) → CO2(g) + 394 kJ
Vad säger oss denna formel? Jo,
- För 1 mol bildad CO2(g) avges 394 kJ värme
- Produkterna har lägre energiinnehåll än reaktanerna. Därför blir \(\Delta H\) negativt, enligt
\(\Delta H = H_{\text{CO}_2} - (H_{\text{C}} + H_{\text{O}_2})\)
- \(\Delta H = -394\text{kJ}\)
\(\Delta H\) vid exo- och endoterma reaktioner
För exoterma reaktioner gäller att \(\Delta H < 0\), för endoterma att \(\Delta H > 0\).