Experimentuppställning
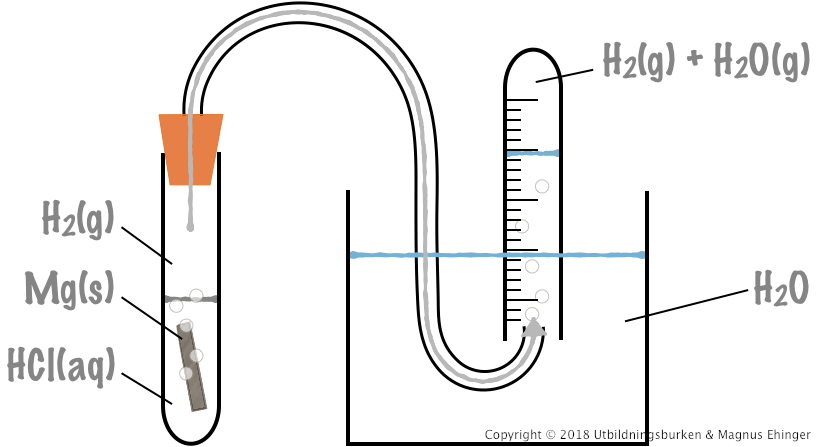 En experimentuppställning som kan användas för bestämning av molmassan för Mg.
En experimentuppställning som kan användas för bestämning av molmassan för Mg.
När magnesium reagerar med saltsyra bildas vätgas enligt nedanstående reaktionsformel:
Mg(s) + 2HCl(aq) → Mg2+(aq) + H2(g) + 2Cl–(aq)
Vätgasen bubblar upp genom glasröret i det graderade provröret, och volymen total gas (H2(g) + H2O(g)) kan mätas. Med hjälp av allmänna gaslagen \(pV=nRT\), reaktionsformeln och massan på magnesiumet som reagerar kan molmassan för magnesium beräknas.
Exempel
0,0309 g magnesium får reagera med saltsyra. Det bildas 32,1 ml gas. Lufttrycket var 101,3 kPa och temperaturen 25,0 °C. Beräkna molmassan för magnesium!
Lösning
Molmassan för magnesium ges av \(M_\text{Mg} = \frac {m_\text{Mg}}{n_\text{Mg}}\).
I reaktionsformeln kan vi se att \(n_\text{Mg}:n_{\text{H}_2} = 1:1\). Därför blir \(n_\text{Mg} = n_{\text{H}_2}\).
Allmänna gaslagen ger:
\[n_\mathrm{H_2} = \frac {p_\mathrm{H_2} \cdot V}{RT} \hspace{100cm}\]
Daltons lag ger att \(p_\text{tot} = p_{\text{H}_2} + p_{\text{H}_2\text{O}}\).
\[p_{\mathrm{H_2}} = p_\mathrm{tot} - p_\mathrm{H_2O} \hspace{100cm}\]
\(p_\text{tot} = 101,3\text{kPa}\) (ur uppgiften)
\(p_{\text{H}_2\text{O}} = 3,17\text{kPa}\) (ur tabell)
\[p_{\text{H}_2} = (101,3-3,17)\text{kPa} = 98,13\text{kPa} = 98130\frac {\text{N}}{\text{m}^2} \hspace{100cm}\]
\[V = 32,1\text{ml} = \frac {32,1}{1000000}\text{m}^3 = 0,0000321\text{m}^3 \hspace{100cm}\]
\[R = 8,314\frac {\text{Nm}}{\text{mol}\cdot \text{K}} \hspace{100cm}\]
\[T = (25,0+273,15)\text{K} = 298,15\text{K} \hspace{100cm}\]
\[n_{\text{H}_2} = \frac {98130\frac {\text{N}}{\text{m}^2}\cdot 0,0000321\text{m}^3}{8,314\frac {\text{Nm}}{\text{mol}\cdot \text{K}}\cdot 298,15\text{K}} = 0,001270755498\text{mol} \hspace{100cm}\]
\[n_\text{Mg} = n_{\text{H}_2} = 0,001270755498\text{mol} \hspace{100cm}\]
\[M_\text{Mg} = \frac {m_\text{Mg}}{n_\text{Mg}} = \frac {0,0309\text{g}}{0,001270755498\text{mol}} = 24,3162434069\text{g/mol} \approx 24,3\text{g/mol} \hspace{100cm}\]
Stämmer beräkningen? Kolla mot någon källa! 😉



