Plocka fram
- Konc. HCl
- Utsp. HCl
- Utsp. H2SO4
- Zn-, Al- eller Mg-bleck
- Fossila stenar från Gotland
- Koppartråd
- BTB
- Sugrör
"Fräser" med karbonater.
- Det bildas koldioxid.
Exempel:
- CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O + CO2(g)
Användning:
- Magsaft innehåller HCl(aq), ca 0,01M.
- Saltsyra används för att ställa pH.
Salpetersyra, HNO3
Användning:
- Gödningsmedel: HNO3 + NH3 → NH4NO3
- Kungsvatten (HNO3 + HCl) kan lösa guld.
Bildade salter:
- Nitrater, t.ex. KNO3, används som gödningsmedel.
Svavelsyra, H2SO4
Tvåprotonig, protolyseras i två steg:
- H2SO4 + H2O → HSO\({\sf _4^-}\) + H3O+ (vätesulfatjon bildas)
- HSO\({\sf _4^-}\) + H2O → SO\({\sf _4^{2-}}\) + H3O+ (sulfatjon bildas)
Användning och egenskaper:
- ”Batterisyra” (elektrolyt i bilbatterier)
- Spädning av koncentrerad svavelsyra: SIV-regeln (Syran hälles I Vattnet – aldrig tvärtom)!
Bildade salter:
- Sulfater, till exempel gips (CaSO4).
Koncentrerad svavelsyra är hygroskopisk.
- Drar till sig vatten – ibland till och med där det egentligen inte ens finns något!
- Det händer när svavelsyran får reagera med kolhydrater, som till exempel socker. Då drar svavelsyran ut allt vatten (egentligen allt syre och väte) ur kolhydraten, och kvar blir bara en svart pelare av kol.
 Det blir bara kvar en svart pelare av kol när svavelsyran fått reagera med socker.
Det blir bara kvar en svart pelare av kol när svavelsyran fått reagera med socker.
Fosforsyra, H3PO4
"Medelstark" syra.
Treprotonig, protolyseras i tre steg:
- H3PO4 + H2O → H2PO\({\sf _4^-}\) + H3O+ (divätefosfatjon bildas)
- H2PO\({\sf _4^-}\) + H2O → HPO\({\sf _4^{2-}}\) + H3O+ (vätefosfatjon bildas)
- HPO\({\sf _4^{2-}}\) + H2O → PO\({\sf _4^{3-}}\) + H3O+ (fosfatjon bildas)
Användning
- Fosfater = gödningsmedel.
- Livsmedel, t.ex. Coca-cola.
Några svaga syror
Kolsyra, H2CO3
Bildas när koldioxid löses i vatten: CO2(g) + H2O → H2CO3(aq)
- Ökad koldioxidhalt i atmosfären ⇒ försurade sjöar och hav!
Tvåprotonig, protolyseras i två steg:
- H2CO3 + H2O → HCO\(_3^-\) + H3O+ (vätekarbonatjon bildas)
- HCO\({\sf _3^-}\) + H2O → CO\(_3^{2-}\) + H3O+ (karbonatjon bildas)
Bildade salter:
- Karbonater, t.ex. kalciumkarbonat, CaCO3.
- Vätekarbonater, t.ex. natriumvätekarbonat (bikarbonat), NaHCO3.
Demonstration: Upplösning av en fossil sten (400–500 miljoner år gammal)
Fossil löses upp i saltsyra.
Fräser, ty CO2 bildas.
Reaktionsformel:
- CaCO3(s) + 2H+ + 2Cl– → Ca2+ + H2O + CO2(g) + 2Cl–
Karbonater "fräser" med saltsyra!
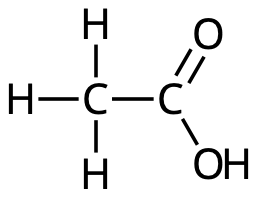
Ättiksyra, HAc (CH3COOH)
Bildas när etanol oxideras (Kemi 2).
Protolys:
- CH3COOH + H2O → CH3COO– + H3O+ (acetatjon bildas)
- HAc + H2O → Ac– + H3O+
Användning: Matlagning (vinäger), kemisk syntes.
Bildade salter:
- Acetater, till exempel natriumacetat (NaAc, NaCH3COO).
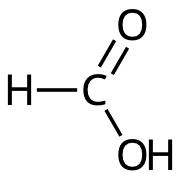
Myrsyra, HCOOH
Bildade salter:
- Formiater, till exempel kaliumformiat, KHCOO.
Ett par starka baser
Jonföreningar med hydroxidjoner, OH–.
Exempel: Natriumhydroxid (NaOH), kaliumhydroxid (KOH)
När de löses i vatten bildas hydroxidjoner, som gör lösningen basisk:
- NaOH(s) → Na+(aq) + OH–(aq)
- KOH(s) → K+(aq) + OH–(aq)
Hydroxidjonen är en bas!
Användning: Reglera pH, propplösare.
Ett par svaga baser
Ammoniak, NH3
NH3 + H2O → NH\(_4^+\) + OH– (ammoniumjon bildas)
- Användning: Konstgödsel, rengöringsmedel
Metylamin, CH3NH2
CH3NH2 + H2O → CH3NH\(_3^+\) + OH– (metylammoniumjon bildas)
- Användning: Lösningmedel, organisk syntes.