Videogenomgång (flippat klassrum)
English-speaking or IB student? Check out the English version instead!
 Plocka fram
Plocka fram
- U-rör
- CuCl2(aq)
- Spänningsaggregat
- Kolelektroder
- Sladdar
- Stativ, muff, klämmare
- Na(s)
- Kristallisationsskål
- Filterpapper
- Morakniv
- Degeltång
- Fenolftalein
Elektrolys
Koppar oxideras av klorgas, vilket vi ju konstaterat innan.
Det sker enligt följande reaktion:
- Cu(s) + Cl2(g) → Cu2+(aq) + 2Cl–(aq)
Reaktionen är spontan, energi avges.
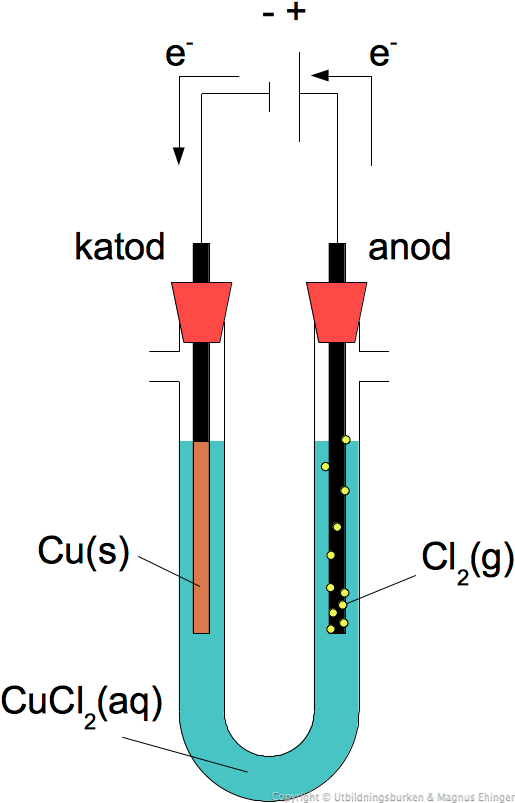
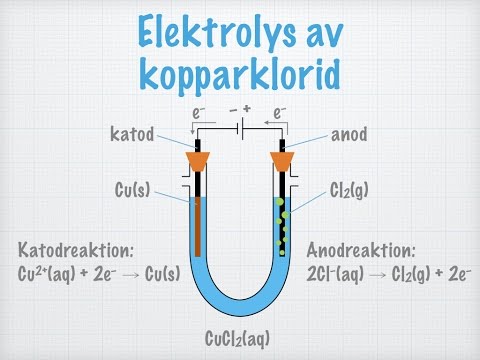
Elektrolys av kopparklorid
Genom att lägga på en elektrisk ström på en lösning av CuCl2(aq) kan man köra processen "baklänges".
Det sker i så fall enligt följande reaktion:
- Cu2+(aq) + 2Cl–(aq) + elektrisk energi → Cu(s) + Cl2(g)
Elektrolys betyder ungefär "sönderdelning (lysis) med hjälp av elektricitet".
- Det som "sönderdelas" här är alltså kopparkloriden, eftersom det bildas fast koppar och klorgas.
Vid katoden sker det en reduktion av koppar(II)joner:
- Cu2+(aq) + 2e– → Cu(s)
Vid anoden sker det en oxidation av kloridjoner:
- 2Cl–(aq) → Cl2(g) + 2e–
Med hjälp av batteriet/strömkällan "trycks" elektronerna i en riktning de egentligen inte vill, och därför bildas den fasta kopparn och klorgasen.
Framställning av NaOH
Natriumhydroxid = viktig industriell kemikalie!
Fråga eleverna, vad används den till (bland annat)?
- Generell basgörare.
- Pappersmassa- och tvåltillverkning.
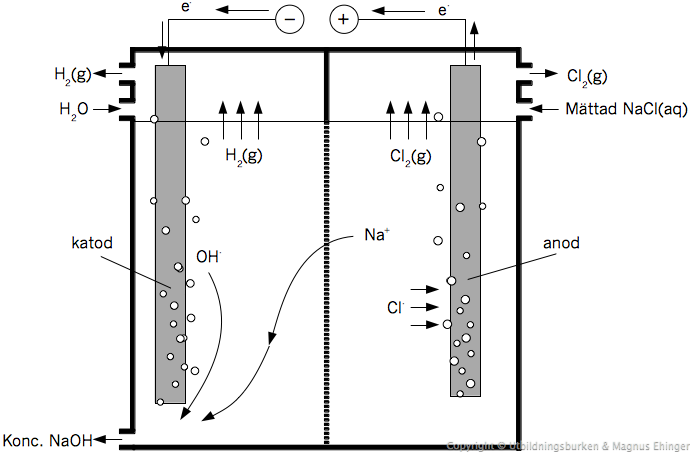 Framställning av natriumhydroxid.
Framställning av natriumhydroxid.
Reaktionen i bilden ovan är inte spontan.
- för att den ska krävs att vi lägger på en spänning, och "tvingar" elektronerna att röra sig.
Elektronerna rör sig från minuspolen till pluspolen.
- Detta gäller också för galvaniska element!
- Den elektrod där elektronerna finns i överskott kallas katod.
- Den elektrod där elektronerna finns i underskott kallas anod.
Eftersom elektronerna finns i underskott vid anoden rör sig de negativt laddade Cl– -jonerna mot anoden.
- Mnemotekniskt knep: negativa joner rör sig mot anoden. "n-joner till an-oden".
Reaktioner vid anod och katod
Vid anoden sker en en oxidation:
- 2Cl– (aq) → Cl2 (g) + 2e–
Elektronerna rör sig genom ledningen till katoden.
Två reaktioner möjliga:
- Na+ (aq) + e– → Na(s) e0 = –2,71V
- 2H2O + 2e– → H2(g) + 2OH–(aq) e0 = –0,83V
Vilken av dessa sker?
- Vi kan resonera kemiskt: Vad händer med Na(s) i vatten?
- Visa detta, om det behövs!
2Na(s) + 2H2 O → 2Na+(aq) + 2OH–(aq) + H2
- Är det alltså troligt att det bildas en massa Na(s) vid reaktionen? Nej!
- Visa detta, om det behövs!
- Vi kan också ta hjälp av normalpotentialerna:
- Minns från förra lektionen: Ju högre normalpotential, desto starkare oxidationsmedel - och desto "hellre" vill ämnet ifråga "knycka" elektroner från ett annat ämne! 😊
- Alltså vill vattnet i lösningen hellre reduceras än natriumjonerna ⇒ Vätgas och hydroxidjoner bildas.
Tillbaka till bilden: Vid katoden bildas hydroxidjoner – ett överskott på negativa laddningar.
Natriumjoner vandrar över membranet, mot katoden.
Reaktioner som sker:
Anodreaktion: 2Cl–(aq) → Cl2 (g) + 2e–
Katodreaktion: 2H2O + 2e– → H2(g) + 2OH–(aq)
Totalreaktion: 2H2O + 2Cl–(aq) → H2(g) + 2OH–(aq) + Cl2(g)