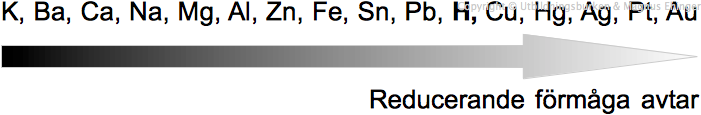En liten räkneuppgift
Välj en valfri väteutdrivande metall! Hur stor volym vätgas bildas om 10,0g av den metallen får lösas i saltsyra? Gasens molvolym Vm = 24,5 dm3/mol vid de förhållanden som råder.
Lösning
Alla ämnen till vänster om H i den elektrokemiska spänningsserien är väteutdrivande, d.v.s. det bildas vätgas om de får reagera med en sur lösning.
Låt oss säga att vi väljer metallen kalcium, Ca.
Vi börjar med att skriva en reaktionsformel:
| Ca(s) + 2HCl(aq) → CaCl2(aq) + | H2(g) | |
| m | \[10,0\mathrm{g}\] | |
| n | \[\begin{aligned} n_{\text{Ca}} &= \frac {m_{\text{Ca}}}{M_{\text{Ca}}} = \frac{10\text{g}}{40,1\text{g/mol}} \\ &= 0,24937656\text{mol} \end{aligned}\] | \[\begin{aligned} n_{\text{H}_2} &= n_{\text{Ca}} = \\ &= 0,24937656\text{mol} \end{aligned}\] |
Vi kan nu beräkna volymen bildad vätgas med hjälp av molvolymen:
\[\begin{aligned} V_{\text{H}_2} &= V_{\text{m}} \cdot n_{\text{H}_2} = 24,5 \frac{\text{dm}^3}{\text{mol}} \cdot 0,24937656\text{mol} = \hspace{100cm} \\ &= 6,1097257 \text{dm}^3 \approx 6,1 \text{dm}^3 \end{aligned}\]
Halogener är oxidationsmedel
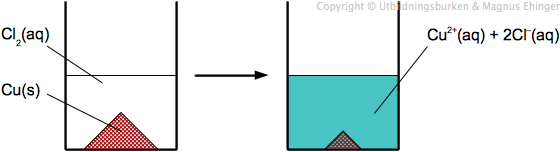
Demonstrationsexperiment: Klorgas kan oxidera koppar
|
Häll klorin (NaClO) i ett provrör Tillsätt saltsyra. Cl2(aq) bildas enligt följande: ClO–(aq) + Cl–(aq) + 2H+(aq) → Cl2(aq) + H2O |
- Häll lite Cu-pulver i Cl2(aq)
- Lösningen blir blågrön – det har bildats Cu2+
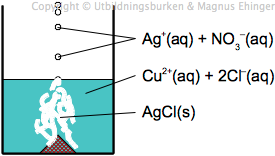
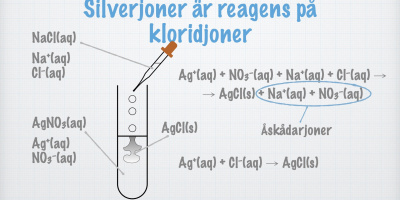
- Tillsätt AgNO3(aq)
- Fällning av AgCl(s) bildas – lösningen innehåller Cl–
Slutsats 1: Cu(s) + Cl2(aq) → Cu2+(aq) + 2Cl–(aq)
Slutsats 2: Halogener är oxidationsmedel!
Olika halogener är olika kraftiga oxidationsmedel
Vilken halogen som är det kraftigaste oxidationsmedlet?
- Fluor, F2
Varför? – För att elektronerna känner av kärnladdningen starkare, dras hellre dit...
Fluorgas får bubbla genom en lösning av natriumjodid. Vilken reaktion sker? Vilket ämne oxideras resp. reduceras?
F2(g) + 2I–(aq) → 2F–(aq) + I2(aq)
- F2 reduceras
- I– oxideras