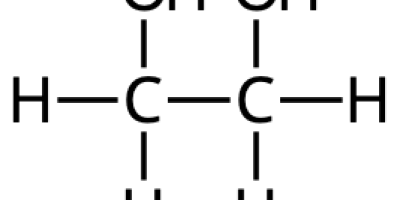Tid: 75 minuter
Tillåtna hjälpmedel: Penna, suddgummi, linjal.
Betygsmatris
Dina svar kommer att bedömas enligt nedanstående matris:
|
| E | C | A |
| Begrepp, modeller, teorier och arbetsmetoder | Eleven redogör översiktligt för innebörden av dem | … utförligt … | … utförligt och nyanserat … |
| Svara på frågor om och beskriva kemiska företeelser och förlopp | Med viss säkerhet, exemplifierar | Med viss säkerhet, exemplifierar | Med säkerhet, exemplifierar och generaliserar kring |
| Analysera och besvara frågor | Enkla frågor i bekanta situationer med tillfredsställande resultat | Komplexa … bekanta situationer … tillfredsställande … | Komplexa … bekanta och nya situationer … gott … |
Vid varje fråga står det vad som bedöms och på vilken nivå du kan besvara frågan.
Hoppa direkt till …
Del I. Frågor som bara kräver ett kort svar (ett ord eller 1-2 meningar)
- Vilket pH har en lösning
- som består av 0,00125 mol/dm3 salpetersyra, HNO3?
Begrepp, modeller, teorier och arbetsmetoder E C A - där man löst 1,25 g natriumhydroxid, NaOH, i 0,200 dm3 vatten?
Begrepp, modeller, teorier och arbetsmetoder E C A
- som består av 0,00125 mol/dm3 salpetersyra, HNO3?
- Vid ett försök för man in kvävgas och vätgas i ett lufttätt kärl och upphettar blandningen till 400 °C. Då sker följande reaktion:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Man fann att vid jämvikt innehöl kärlet 0,30 mol kvävgas, 0,20 mol vätgas och 0,070 mol ammoniak per dm3. Beräkna reaktionens jämviktskonstant.
| Begrepp, modeller, teorier och arbetsmetoder | E | C | A |
- I bland annat havsvatten finns det vätekarbonatjoner. Dessa protolyseras enligt följande formel:
HCO\(_3^-\) + H2O ⇌ CO\(_3^{2-}\) + H3O+
Vilka syrabaspar finns det i den reaktionen?
Begrepp, modeller, teorier och arbetsmetoder E C A - I en jämviktsreaktion A + B ⇌ C + D har man nedanstående energiförhållanden.

- Hur stor är aktiveringsenergin för reaktionen A + B → C + D?
- Hur stor är aktiveringsenergin för reaktionen C + D → A + B?
- Hur stor är entalpiförändringen för reaktionen A + B → C + D?
- Är reaktionen A + B → C + D endoterm eller exoterm?
Analysera och besvara frågor E C A - Man kan framställa väteklorid genom att låta vätgas reagera med klorgas enligt följande reaktion:
H2(g) + Cl2(g) ⇌ 2HCl(g)
\(\Delta H = -184k\mathrm{J}\) för reaktionen åt höger
Hur ska man göra för att förskjuta reaktionen åt höger? Ett eller flera alternativ kan vara korrekta.- Man minskar koncentrationen HCl
- Man minskar koncentrationen H2
- Man ökar koncentrationen Cl2
- Man höjer temperaturen
- Man ökar trycket genom att minska volymen
Svara på frågor om och beskriva kemiska företeelser och förlopp E C A
Del II. Frågor som kräver ett utredande svar (fullständiga beräkningar krävs)
- I ett försök ville man bestämma koncentrationen myrsyra, HCOOH, i en lösning. Man titrerade 15,0 ml av myrsyran med 0,100 mol/dm3 natriumhydroxid, samtidigt som man mätte lösningens pH. Då fick man följande diagram:

- Vilket pH (ungefär) hade lösningen vid ekvivalenspunkten?
Svara på frågor om och beskriva kemiska företeelser och förlopp E C A - Beräkna myrsyrans koncentration.
Svara på frågor om och beskriva kemiska företeelser och förlopp E C A
- Vilket pH (ungefär) hade lösningen vid ekvivalenspunkten?
- Man tillreder en buffert genom att blanda 20 ml 0,20 mol/dm3 HAc med 20 ml 0,80 mol/dm3 NaAc. Beräkna lösningens pH.
Analysera och besvara frågor E C A - I bilmotorer bildas bland annat kvävemonoxid genom att luftens kväve reagerar med syrgas vid hög temperatur. Vid 2500 K är jämviktskonstanten \(K = 4,3 \cdot 10^{-2}\) för följande reaktion:
N2(g) + O2(g) ⇌ 2NO(g)
I ett försök blandade man 1,00 mol kvävgas, 1,00 mol syrgas och 1,00 mol kvävemonoxid i ett lufttätt kärl med volymen 1,00 dm3 och upphettade till 2500 K. Vilken var koncentrationen kvävemonoxid när systemet nådde jämvikt?Analysera och besvara frågor E C A
Facit
Betygsgränser
| Max: | 16 | (10/5/1) | |
| Medel: | 10,72 | (7,94/2,50/0,28) | |
| E: | 7,5 | ||
| D: | 10,0 | varav | 2,5 A- eller C-poäng |
| C: | 12,5 | varav | 4,0 A- eller C-poäng |
| B: | 13,0 | varav | 0,5 A-poäng |
| A: | 14,5 | varav | 1,0 A-poäng |
Det här provets omfattning är egentligen för liten för att kunna sätta B- eller A-betyg. Men den som har 13,0 poäng eller mer, oavsett fördelning på C- eller A-poäng, har rätt så goda chanser att nå något av de högre betygen.
Del I. Frågor som bara kräver ett kort svar (ett ord eller 1-2 meningar)
- pH = 2,903
- pH = 13,193
- K = 2,04M-2
- HCO\(_3^-\)/CO\(_3^{2-}\) och H3O+/H2O
- ∆H2
- ∆H3
- ∆H1
- exoterm
- a, c
Del II. Frågor som kräver ett utredande svar (fullständiga beräkningar krävs)
- pH ≈ 8
- HCOOH + OH– ⇌ HCOO– + H2O
Vid ekvivalenspunkten är \(n_\mathrm{HCOOH} = n_\mathrm{NaOH}\).
\[\begin{align}n_{\text{NaOH}} &= c_{\text{NaOH}} \cdot V_{\text{NaOH}} = 0,100 \text{mol/dm}^3 \cdot 0,025\text{dm}^3 = \hspace{100cm} \\ &= 0,0025\text{mol}=n_{\text{HCOOH}}\end{align}\]
\[c_{\text{HCOOH}}=\frac {n_{\text{HCOOH}}}{V_{\text{HCOOH}}} = \frac {0,0025\text{mol}}{(0,015\text{dm}^3 )} = 0,16666667\text{mol/dm}^3 \approx 0,167\text{M} \hspace{100cm}\]
- Eftersom lösningarna späds till dubbla volymen, blir koncentrationerna halverade.
\(c_{\text{HAc}} = 0,10\text{M}\); \(c_{\text{Ac}^-} = 0,40\text{M} \hspace{100cm}\)
\(\mathrm{p}K_\mathrm{a} = 4,74\) (ur formelsamlingen)
Buffertformeln ger:
\[\text{pH} = \text{p}K_{\text{a}}-\log\left(\frac {c_{\text{syra}}}{c_{\text{bas}}}\right) = 4,74 - \log\left(\frac {0,10}{0,40}\right)=5,31205999 \approx 5,31 \hspace{100cm}\]
E – Eleven beräknar pH utan att ta hänsyn till halveringen av koncentrationerna (frågan blir då bara enkel).
C – Eleven beräknar pH fullständigt korrekt (frågan blir då mera komplex). Även om resultatet i det här specifika fallet blir exakt detsamma som om man inte tar hänsyn till spädningarna, är eleven inte uppe på C-nivå förrän man antingen tagit hänsyn till spädningarna eller visat att de (i det här fallet) inte spelar någon roll. -
\[Q = \frac{\text{[NO]}^2}{\text{[N}_2\text{][O}_2\text{]}} =\frac {1,00^2\text{M}^2}{1,00\text{M} \cdot 1,00\text{M}} = 1 > 4,3 \cdot 10^{-2} = K \hspace{100cm}\]
Eftersom \(Q > K\) går reaktionen åt vänster
N2 +
O2 ⇌
2NO
f.r.
\[1,00\]
\[1,00\]
\[1,00\]
M
Δ
\[+ x\]
\[+ x\]
\[- 2x\]
M
v.j.
\[1,00 + x\]
\[1,00 + x\]
\[1,00 – 2x\]
M
\[K = \frac{\text{[NO]}^2}{\text{[N}_2\text{][O}_2\text{]}} \hspace{100cm}\]
\[4,3 \cdot 10^{-2}= \frac {(1,00-2x)^2}{(1,00+x)(1,00+x)} = \frac {(1,00-2x)^2}{(1,00+x)^2} \hspace{100cm}\]
\[\sqrt{4,3 \cdot 10^{-2}}= \sqrt{\frac {(1,00-2x)^2}{(1,00+x)^2}} = \frac {1,00-2x}{1,00+x} \hspace{100cm}\]
\[(1,00+x) \cdot \sqrt{4,3 \cdot 10^{-2}}= 1,00-2x \hspace{100cm}\]
\[\sqrt{4,3 \cdot 10^{-2}} + x \cdot \sqrt{4,3 \cdot 10^{-2}}= 1,00-2x \hspace{100cm}\]
\[x \cdot \sqrt{4,3 \cdot 10^{-2}} + 2x= 1,00 - \sqrt{4,3 \cdot 10^{-2}} \hspace{100cm}\]
\[x \cdot (\sqrt{4,3 \cdot 10^{-2}} + 2) = 1,00 - \sqrt{4,3 \cdot 10^{-2}} \hspace{100cm}\]
\[x = \frac {1,00 - \sqrt{4,3 \cdot 10^{-2}}}{\sqrt{4,3 \cdot 10^{-2}} + 2} = 0,35908687 \hspace{100cm}\]
\[\begin{align}\text{[NO]} &= (1,00 - 2x)\text{M} = (1,00 - 2\cdot 0,35908687)\text{M} =\hspace{100cm}\\ &= 0,2812625\text{M} \approx 0,28\text{M}\end{align}\]
E – eleven kan beräkna \(Q\) och konstatera att reaktionen går åt vänster.
C – Eleven ställer upp ett korrekt uttryck för att beräkna \(x\).
A – Eleven beräknar koncentrationen NO korrekt.