Substitution = något byts ut.
Substitutionsreaktion:
- En atom i en organisk förening byts ut mot någon annan.
- Radikalsubstitution (Se halogenalkaner för hur det sker).
- Nukleofil substitution (SN2- och SN1-reaktioner).
SN2-reaktioner
Vi låter natriumhydroxid reagera med klormetan
Metanol bildas.
Ordformel:
- Natriumhydroxid + klormetan → metanol + natriumklorid
Kemisk formel:
- CH3Cl + Na+ + OH– → CH3OH + Na+ + Cl–
Vad är det som händer, egentligen?
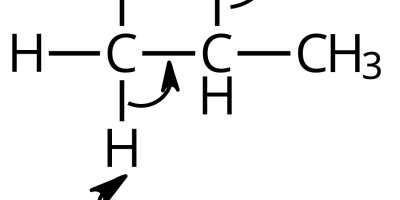
Bindningen mellan klor och kol är starkt polär: kloratomen är starkt elektronegativ.
OH–-jonen attackerar kolatomen.
- Hydroxidjonen är nukleofil - "kärnälskande".
- Nukleofil attack.
Kallas SN2-reaktioner, eftersom
- S för substitution;
- N för nukleofil (attack);
- 2 för att reaktionshastigheten är beroende av två molekylers koncentration (bimolekylär reaktion).
Energiomsättning vid SN2-reaktioner
Reaktionen sker i ett enda steg; i ett enda "svep".
Transitionstillståndet har högre entalpi än produkterna.
- Hög energi = mer instabilt!
- Reagerar mycket snabbt vidare till de mer stabila produkterna.
SN1-reaktioner
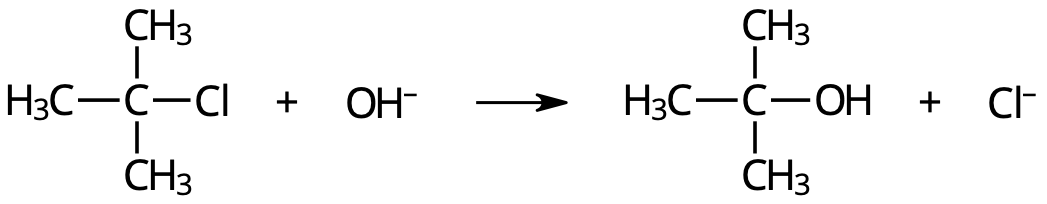
Natriumhydroxid (hydroxidjoner) får reagera med teritär butylklorid (2-klor-2-metylpropan).
- Det bildas 2-metyl-2-propanol + kloridjoner:
Denna reaktion har en annan mekanism än SN2-reaktionen. Det finns nämligen inte utrymme för en hydroxidjon att göra en nukleofil attack på kolatomen.
Reaktionen sker i två steg.
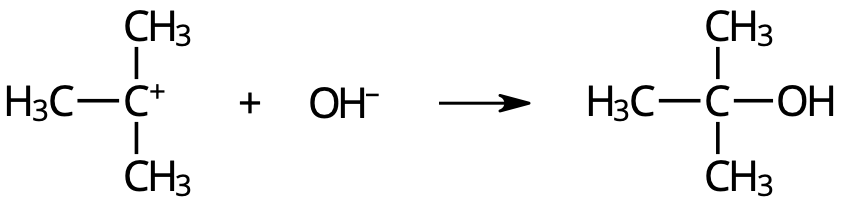
1. Kloratomen lossnar från 2-klor-2-metylpropanmolekylen:
- Långsam reaktion.
- Karabokatjonen är en intermediär.
- Reaktionen har hög aktiveringsenergi.
2. Karbokatjonen reagerar med hydroxidjonen:
- Snabb reaktion!
- Låg aktiveringsenergi, jämfört med karbokatjonens energiinnehåll.
Kallas SN1-reaktion, därför att reaktionshastigheten endast beror på koncentrationen 2-klor-2-metylpropan.
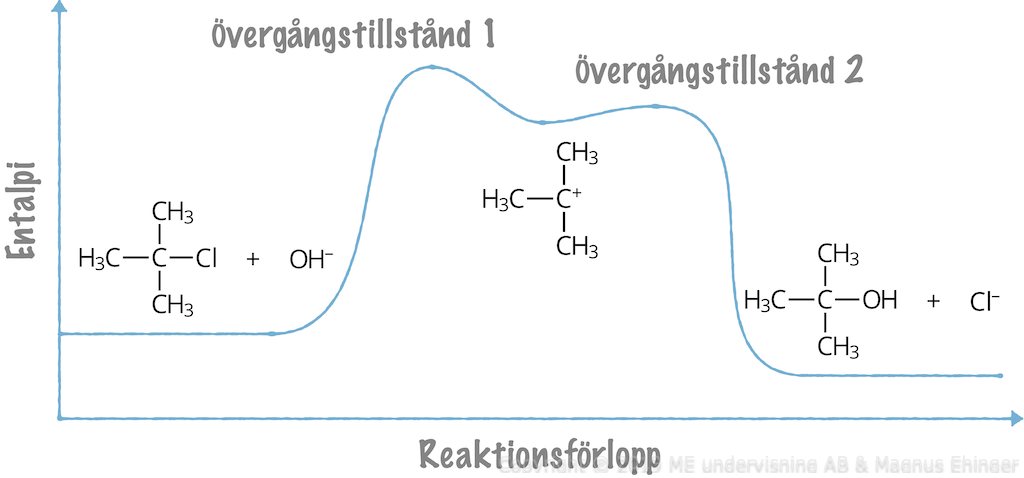
Energiomsättning vid SN1-reaktioner
Reaktionen sker i två steg.
Aktiveringsenergin är mycket hög i det första steget:
- Reaktionen sker sällan, och därmed överlag långsammare.
Aktiveringsenergin är mycket mindre i det andra steget (från intermediären till övergångstillstånd 2).
- Reaktionen sker mycket snabbare än det första steget.
- Därför beror den totala reaktionshastigheten framför allt på en enda reaktant, koncentrationen 2-klor-2-metylpropan.