Nitrering
Ett kolväte behandlas med salpetersyra, och en eller flera väteatomer substitueras med en nitrogrupp, –NO2.
Exempel:
- metan + salpetersyra → nitrometan + vatten
- CH4 + HNO3 → CH3NO2 + H2O
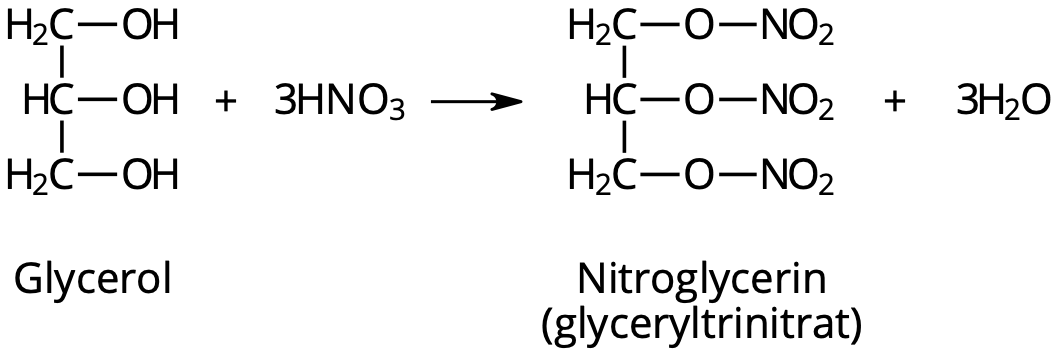
Nitroglycerin och dynamit
Man kan nitrera glycerol med svavelsyra som katalysator. Då bildas nitroglycerin.
Nitroglycerin är egentligen ett organiskt nitrat, eftersom det innehåller den kemiska gruppen –NO3. Dess "riktiga" namn är därför glyceryltrinitrat.
Nitroglycerin kan användas för behandling av kärlkramp (angina pectoris).
- Nitroglycerin i kroppen omvandlas till kvävemonoxid, NO.
- Kvävemonoxid är en signalsubstans.
- Den glatta muskulaturen i blodkärlen känner av signalsubstansen, slappnar av, och kärlkrampen släpper.
Nitroglycerin är också mycket explosivt, men instabilt. Alfred Nobel upptäckte dock år 1866 att om man lät nitroglycerinet sugas upp av exempelvis kiselgur (en jordart bestående huvudsakligen av kiseldioxid) blev det mycket mer stabilt, och kunde hanteras mycket lättare. Alfred Nobel kallade sin uppfinning dynamit.
 Nobels ''extradynamit'', tillverkad av Nobels gamla företag, Nitroglycerin Aktiebolaget.
Nobels ''extradynamit'', tillverkad av Nobels gamla företag, Nitroglycerin Aktiebolaget.
Varför är nitroföreningar explosiva?
Syre (oxidationsmedel)
Syret i O2 är oxidationsmedel – men också kvävet i CH3NO2.
- Varför också kvävet?
- Vi tittar på oxidationstalen i CH3NO2, N2 och CO2:
- \(\overset{\text{-III}}{\text{C}}\text{H}_3\overset{\text{+IV}}{\text{N}}\text{O}_2\text{, }\overset{0}{\text{N}}_2, \overset{\text{+IV}}{\text{C}}\text{O}_2\)
- Oxidationstalet sjunker från +IV till 0. Det betyder att kvävet reduceras.
- Samtidigt oxideras kolet, då dess oxidationstal stiger från -III till +IV.
Vid förbränningar av nitroföreningar används det alltså två oxidationsmedel, vilket gör att reaktionen sker extra snabbt.
Värme
Kvävgas är en mycket stabil stabil förening.
- Kväveatomerna sitter ihop med en trippelbindning, N≡N, som är stark.
- Kvävgasen har mycket låg entalpi.
Vi tittar på entalpiförändringen när reaktionen sker:
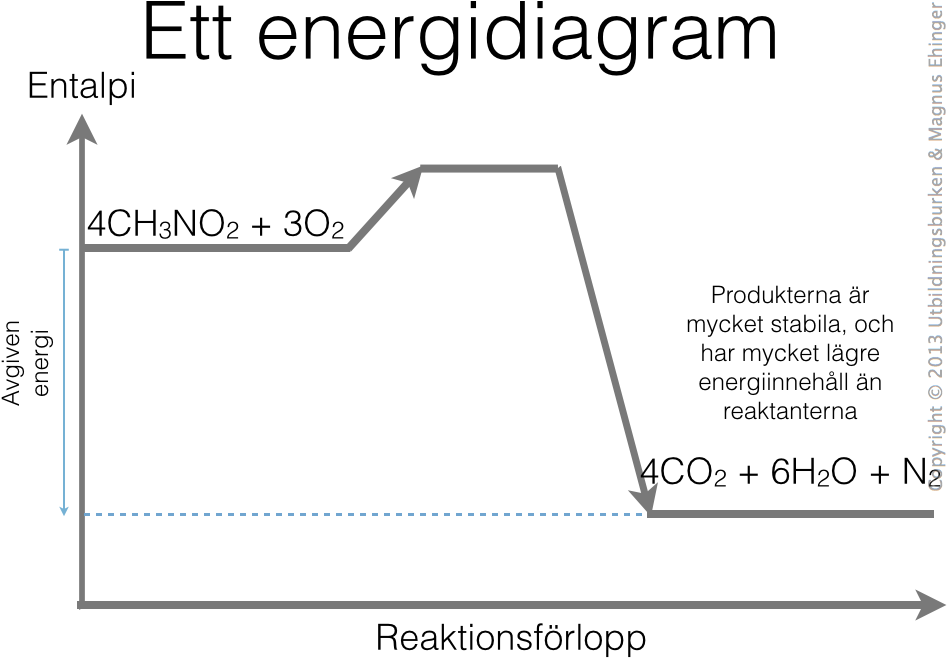 Ett generellt energidiagram vid förbränning av nitroföreningar.
Ett generellt energidiagram vid förbränning av nitroföreningar.
Eftersom kvävgasen är en så stabil förening, har det också mycket låg entalpi. Därmed frigörs det MYCKET värme vid förbränningen.
Explosionen
Vid förbränningen bildas också mycket gas.
- Till vänster om reaktionspilen: 3 gaspartiklar (3O2(g)).
- Till höger om reaktionspilen: 12 gaspartiklar (4CO2(g) + 6H2O(g) + 2N2(g)).
Den varma, expanderande gasen är tryckvågen som för med sig den explosiva verkan.