Några klassiska svårlösliga salter
Silverhalider, till exempel silverjodid, silverbromid och silverklorid, är svårlösliga.
 Uppslamningar av från vänster AgI(s), AgBr(s) och AgCl(s).
Uppslamningar av från vänster AgI(s), AgBr(s) och AgCl(s).
Det bildas fällningar om man blandar en lösning av Ag+(aq) med en lösning av I–(aq), Br–(aq) eller Cl–(aq).
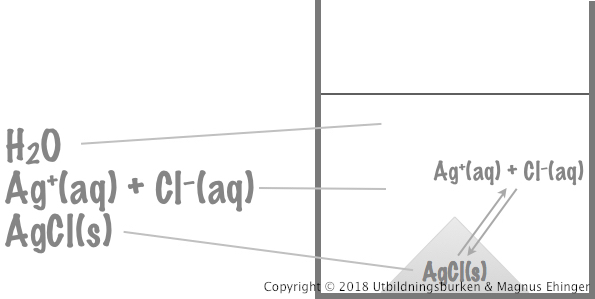
En heterogen jämvikt
Vad händer om det uppstår en jämvikt mellan två olika faser – till exempel en fast fas och en fas löst i vatten?
- Detta händer i mättade saltlösningar!
- Svårlösta salter bildar väldigt snabbt mättade lösningar.
Jämviktsreaktion:
AgCl(s) ⇌ Ag+(aq) + Cl–(aq)
Jämviktskonstant:
\[K = \frac {[\text{Ag}^+\text{(aq)}][\text{Cl}^-\text{(aq)}]}{[\text{AgCl(s)]}}\]
Eftersom AgCl(s) är ett rent, fast ämne förändras inte dess koncentration när jämvikt uppnås ⇒ [AgCl(s)] är konstant.
- Vi "flyttar över" [AgCl(s)] till vänstersidan, och definierar löslighetsprodukten \(K_{\text{s}}\):
\[\underbrace{K \cdot [\text{AgCl(s)]}}_{=K_{\text{s}}} = [\text{Ag}^+\text{(aq)}][\text{Cl}^-\text{(aq)}]\]
Exempel 1. Beräkning med löslighetsprodukten \(K_{\text{s}}\)
Löslighetsprodukten för AgCl(s) i vatten \(K_{\text{s, AgCl}} = 1,77 \cdot 10^{-10}\text{M}^2\). Hur stor är [Ag+] i en mättad lösning av AgCl?
Lösning
Vi börjar med att skriva jämviktsreaktionen och teckna löslighetsprodukten för reaktionen:
AgCl(s) ⇌ Ag+(aq) + Cl–(aq)
\[K_{\text{s, AgCl}} = [\text{Ag}^+\text{(aq)}][\text{Cl}^-\text{(aq)}] \hspace{100cm}\]
Det frågas efter [Ag+(aq)]. Men vad är [Cl–(aq)]?
- Reaktionsformeln ger att [Cl–(aq)] = [Ag+(aq)]
Vi sätter in i uttrycket för löslighetsprodukten \(K_{\text{s, AgCl}}\) och får att
\[K_{\text{s, AgCl}} = [\text{Ag}^+\text{(aq)}]^2 \hspace{100cm}\]
\[[\text{Ag}^+\text{(aq)}] = \sqrt{K_{\text{s, AgCl}}} \hspace{100cm}\]
\[\begin{aligned} \mathrm{[Ag^+(aq)]} &= \sqrt{1,77 \cdot 10^{-10}\text{M}^2} = \hspace{100cm} \\ &= 1,3304134 \cdot 10^{-5}\text{M} \approx 1,33 \cdot 10^{-5}\text{M} \end{aligned}\]
Alltså: Även om vi fäller "alla" silverjoner med kloridjoner, så kommer det att vara kvar 1,33·10–5 mol Ag+(aq) per dm3 lösning.
Exempel 2. Beräkning av löslighetsprodukten
Vid 20 °C kan man lösa maximalt 358,9 g natriumklorid i en dm3 vatten. Vilken är löslighetsprodukten för natriumklorid vid 20 °C, \(K_\text{s, NaCl}\)?
Lösning
Vi får en mättad lösning av natriumklorid, där följande jämvikt ställer in sig:
NaCl(s) ⇌ Na+(aq) + Cl–(aq)
Löslighetsprodukten ges av följande samband:
\[K_\text{s, NaCl} = [\text{Na}^+\text{(aq)}][\text{Cl}^-\text{(aq)}] \hspace{100cm}\]
Eftersom \(n_{\text{NaCl}}:n_{\text{Na}^+}:n_{\text{Cl}^-} = 1:1:1\) (från reaktionsformeln) får vi att
\[[\text{Na}^+] = [\text{Cl}^-] = c_{\text{NaCl}} \hspace{100cm}\]
\[c_{\text{NaCl}} = \frac {n_{\text{NaCl}}}{V} = \frac {\frac {m_{\text{NaCl}}}{M_{\text{NaCl}}}}{V} = \frac {\frac {358,9\text{g}}{(23,0+35,5)\text{g/mol}}}{1\text{dm}^3} = 6,13504274 \text{mol/dm}^3 \hspace{100cm}\]
Löslighetsprodukten \(K_\text{s, NaCl}\) beräknas:
\[K_\text{s, NaCl} = (6,13504274 \text{M})^2 = 37,6387494\text{M}^2 \approx 37,6\text{M}^2 \hspace{100cm}\]