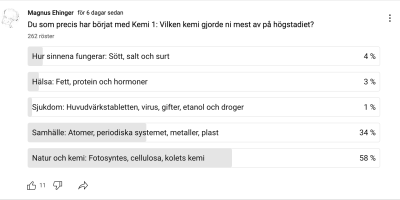
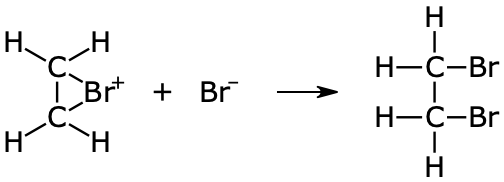Hoppa direkt till:
Det finns två sätt som man kan undervisa om reaktionsmekanismer på. Antingen kan man spara alla olika typer av reaktionsmekanismer till slutet av den organiska kemin, eller så kan man försöka väva in dem på de ställen där de är relevanta. Jag själv föredrar det senare alternativet, men det är inget fel att göra som i det förra. Därför har jag på den här sidan samlat mina videogenomgångar som tar upp reaktionsmekanismer.
Just nu ligger här de videogenomgångar där jag har bakat in olika reaktionsmekanismer. Målet är att så småningom ska här bara ligga videogenomgångar med "rena" reaktionsmekanismer, för den som behöver repetera just det.
Vilka reaktionsmekanismer ska man kunna?
I kursplanen för Kemi 2 skriver skolverket såhär om reaktionsmekanismer.
Följande centrala innehåll ska behandlas:
- Reaktionsmekanismer, inklusive kvalitativa resonemang om, hur och varför reaktioner sker och om energiomsättningar vid olika slags organiska reaktioner.
Skolverket ger alltså ingen ledning om vilka reaktionsmekanismer som eleven förväntas kunna, utan bara att eleven förväntas kunna någon eller några. Därför måste det vara upp till varje lärare/klass/kurs att avgöra vilken eller vilka av reaktionsmekanismerna som ska väljas ut.
För egen del brukar jag ta upp följande reaktionsmekanismer med mina elever:
- Radikalsubstitution och nukleofil substitution, för att förstå hur halogenalkaner kan bildas.
- Elektrofil addition och Markovnikovs regel, för att det är ett så bra exempel på energiomsättningar vid organiska reaktioner
- Radikalpolymerisation, för att plaster är så viktiga i vårt samhälle
I mån av tid och intresse från eleverna, tar vi även upp reaktionsmekanismen för syrakatalyserad estersyntes och elimination.
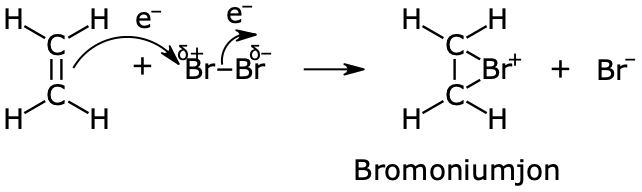
Addition av brom till en dubbelbindning
Denna reaktion sker i två steg.
I första steget sker en elektrofil attack.
- Brom är elektronegativt = "tycker om" elektroner = elektrofilt
- Brom är ett elektrofilt reagens, som attackerar dubbelbindningen
- Bromatomen bildar en tillfällig dipol. Den (något mera) positivt laddade ändan dras mot elektronerna i dubbelbindningen.
- Brom "knycker" en elektron från dubbelbindningen, så att det bildas en s.k. bromoniumjon och en bromidjon.
I steg två reagerar bromoniumjonen med bromidjonen
- Bromoniumjonen är mycket reaktiv
- Det bildas 1,2-dibrometan
Addition av en vätehalogenid till en dubbelbindning (Markovnikovs regel)
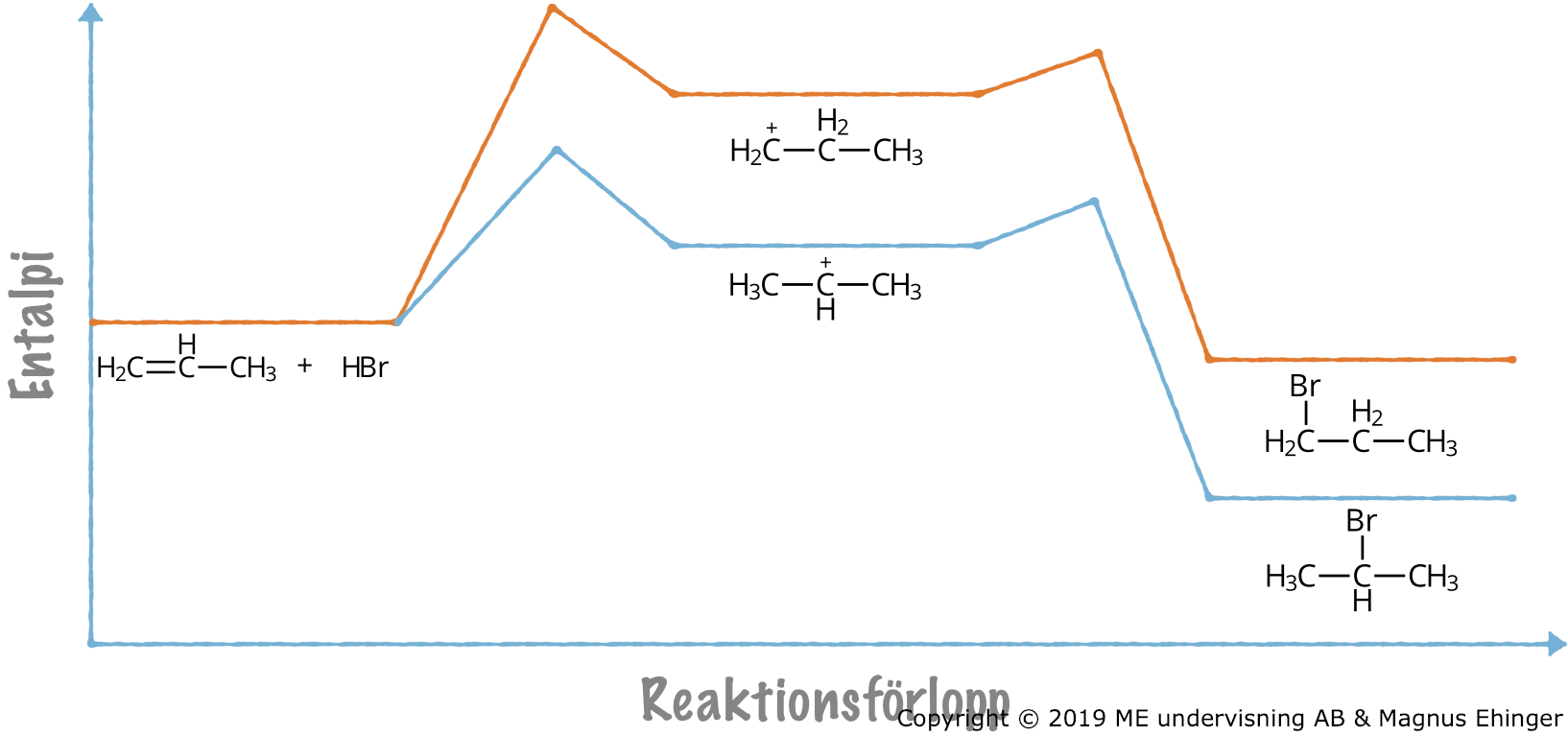
Exempel: Addition av HBr till propen
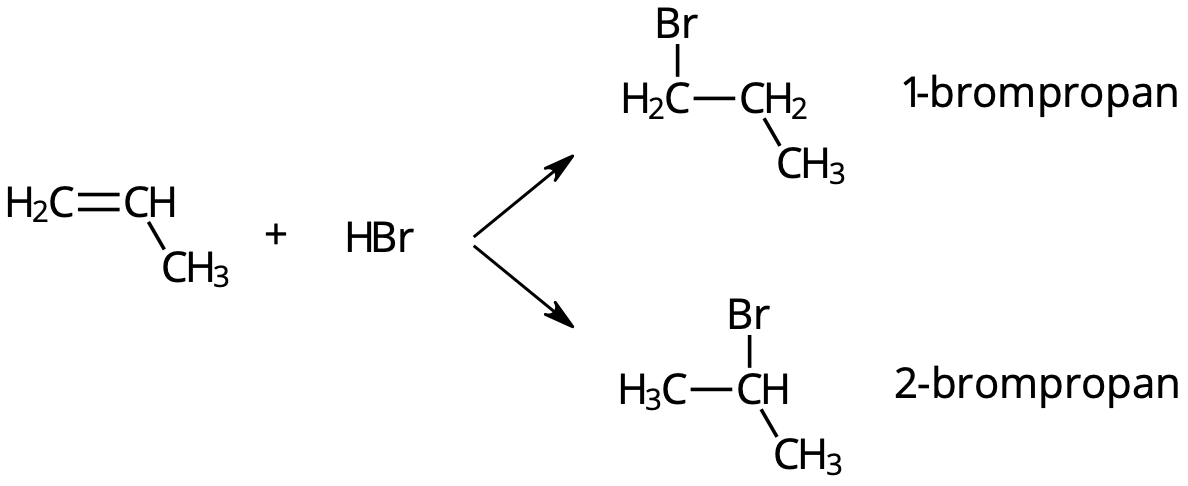 Vid addition av HBr till propen bildas både 1-brompropan och 2-brompropan.
Vid addition av HBr till propen bildas både 1-brompropan och 2-brompropan.
Vätebromid är en dipol. Den positivt laddade väteatomen attackerar dubbelbindningen. Väteatomen går då antingen till kolatom nummer 2 eller 1.
- Det bildas då en primär eller en sekundär karbokatjon som intermediär.
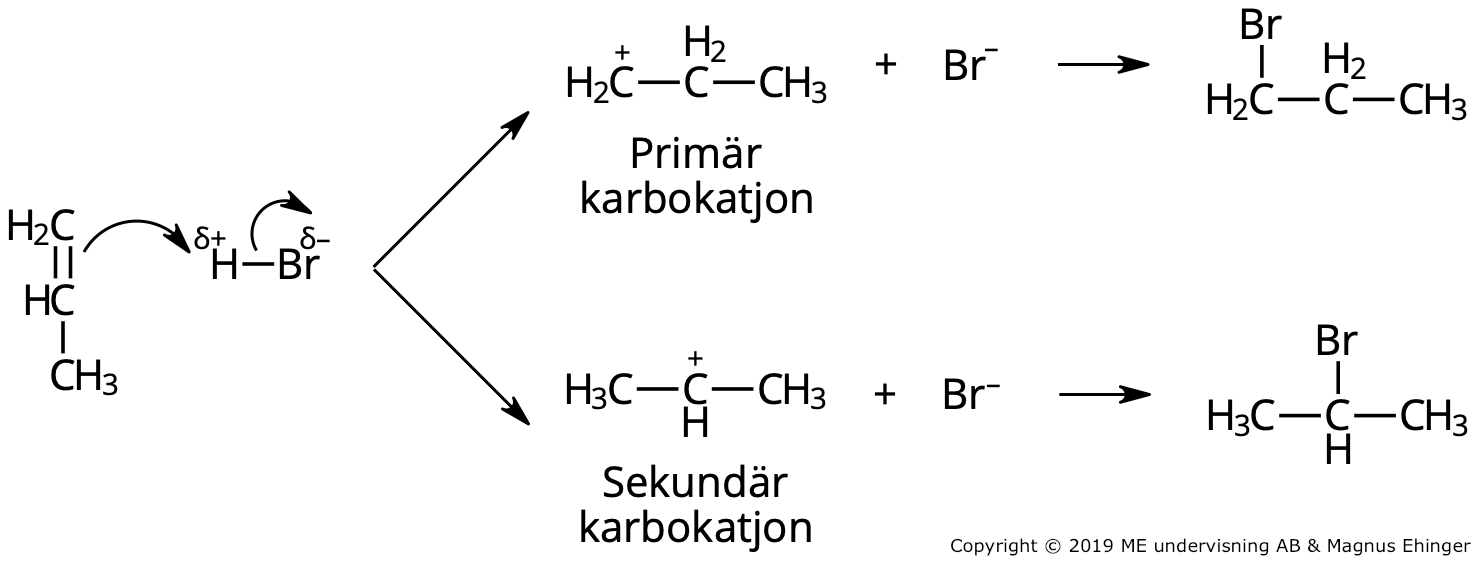 Vid addition av vätebromid till propen bildas det två olika intermediärer: 1- brompropan och 2-brompropan.
Vid addition av vätebromid till propen bildas det två olika intermediärer: 1- brompropan och 2-brompropan.
Den sekundära karbokatjon som bildas är något mer stabil än den primära.
- Den positiva laddningen stabiliseras av båda omgivande kolatomerna i den sekundära karbokatjonen – bara av en kolatom i den primära.
Eftersom den sekundära karbokatjonen är mer stabil än den primära, krävs det mindre energi för den att bildas, och det är större sannolikhet att den bildas. Därför kommer det att bildas mest 2-brompropan vid addition av vätebromid till propen.
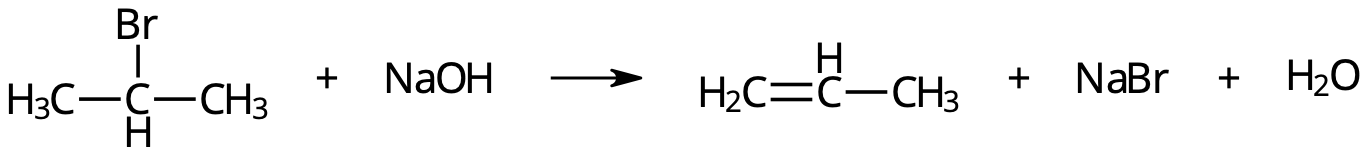
Elimination = "motsats" till addition.
- Två atomer på intilliggande kolatomer plockas bort.
- Dubbelbindning uppstår.
Reaktionsmekanism:
- Den elektronegativa bromatomen tar upp en elektron ⇒ avgår som bromidjon, Br–.
- Väteatom på intilligande kolatom avgår som vätejon, H+ ⇒ bildar H2O i basisk lösning.
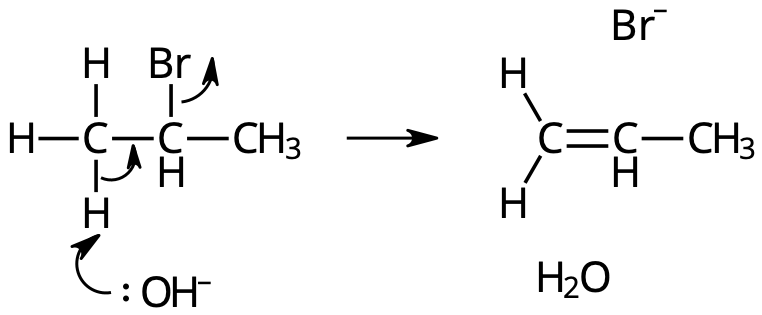 Reaktionsmekanismen för elimination av HBr från 2-brompropan.
Reaktionsmekanismen för elimination av HBr från 2-brompropan.