Substitution
I en metanmolekyl kan man byta ut en (eller flera) av väteatomerna mot exempelvis halogener.
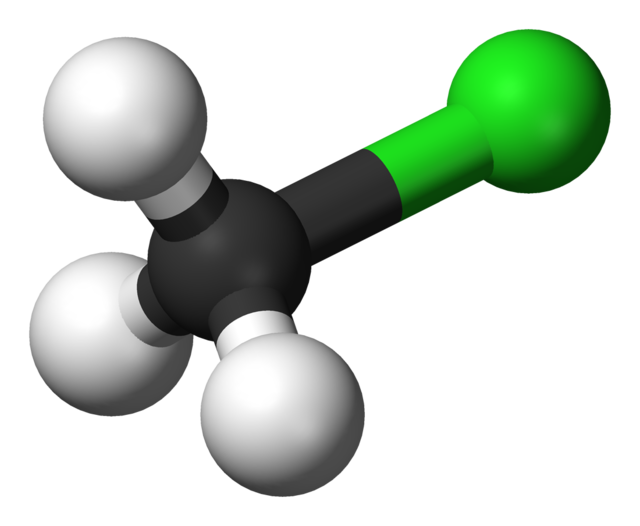
I klormetan har en väteatom bytts ut (substituerats) mot en kloratom.
Reaktionsformel
- CH4 + Cl2 → CH3Cl + HCl
Vid rumstemperatur: Trög reaktion.
Reaktionen går mycket fortare om man tillför energi i form av ljus!
Det starka ljuset gör att det bildas klorradikaler.
- Radikal = atom eller molekyl med en oparad elektron.
- Mycket reaktiv!
Cl2 + hν → Cl· + Cl·
- "Pricken" är en oparad elektron!
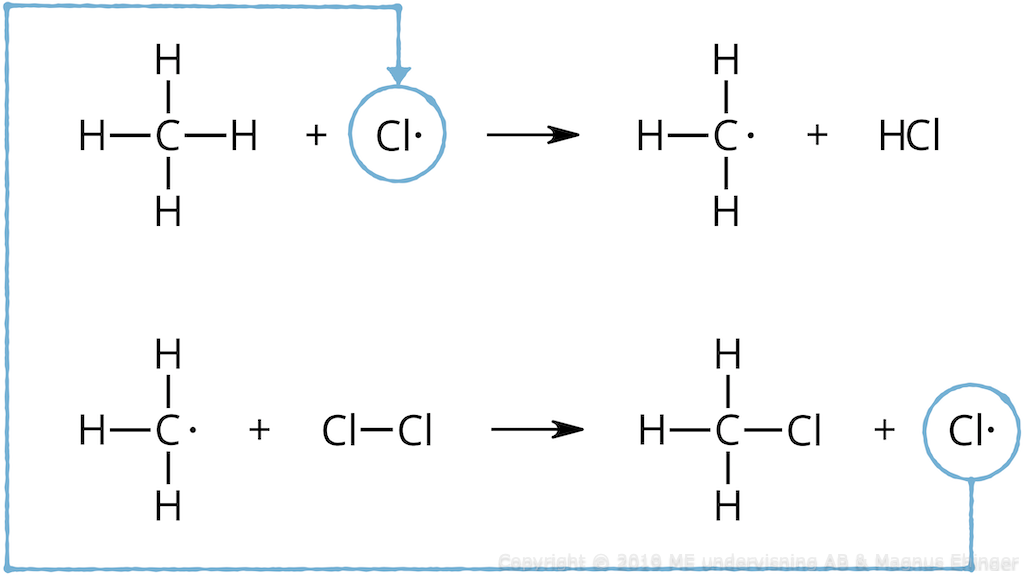
Reaktionen med metan blir en kedjereaktion:
- Cl· + CH4 → CH3· + HCl
- CH3· + Cl2 → CH3Cl + Cl·
- Cl· + … osv
Reaktionskedjan upphör när två radikaler reagerar med varandra.
Namngivning av halogenalkaner
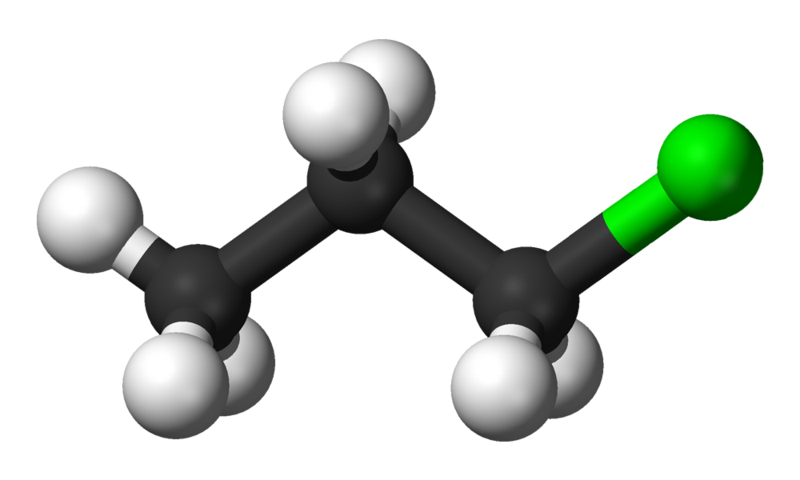
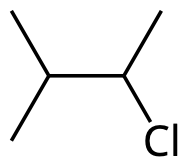
Titta på nedanstående molekyler.
- Båda har summaformel C3H7Cl.
Exempel
Lösning
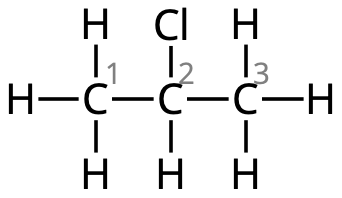
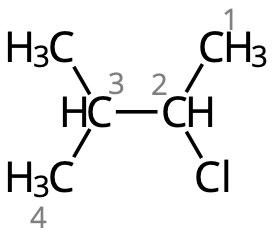
I streckformeln är det så att i varje vinkel och varje ände sitter det kolatomer. Vi kan därför skriva om strukturformeln såhär:
Kolatomerna numreras så att den kolatomer där klor sitter får så lågt nummer som möjligt.
- Fyra kolatomer i kolkedjan ⇒ "-butan".
- Kloratom på kol #2 ⇒ "2-klor-"
- Metylgrupp på kol #3 ⇒ "3-metyl-"
Hela namnet: 2-klor-3-metylbutan.
- Lägg märke till: Substituenterna (prefixen) i bokstavsordning (klor kommer före metyl).
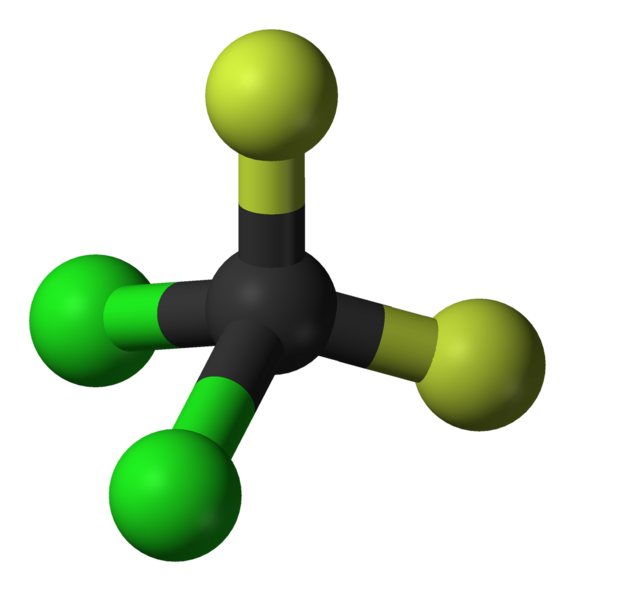
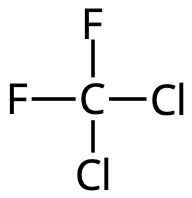
Freoner
Även kallade CFC eller klorofluorokarboner.
Kylmedel i frysar och kylar.
Problem:
- Katalyserar nedbrytningen av ozon (som behövs för att begränsa UV-instrålningen).
- Växthusgas.
Freoner är långlivade molekyler, men utvecklingen är på rätt väg.
Perfluorerade ämnen
Alla väteatomerna i ett kolväte utbytta mot fluor.
Bindningen C–F är den starkaste kovalenta bindningen som existerar ⇒ perfluorerade ämnen är mycket stabila.
- Användning i teflon, i skumsläckare.
Att de är så stabila gör tyvärr att perfluorerade ämnen även är mycket svåra att bryta ner.
- Troligtvis påverkar de både djur- och växtliv (även människa!).