Tid: 90 minuter
Tillåtna hjälpmedel: Formelsamling, miniräknare.
Betygsmatris
Dina svar kommer att bedömas enligt nedanstående matris:
|
| E | C | A |
| Begrepp, modeller, teorier och arbetsmetoder | Eleven redogör översiktligt för innebörden av dem | … utförligt … | … utförligt och nyanserat … |
| Svara på frågor om och beskriva kemiska företeelser och förlopp | Med viss säkerhet, exemplifierar | Med viss säkerhet, exemplifierar | Med säkerhet, exemplifierar och generaliserar kring |
| Analysera och besvara frågor | Enkla frågor i bekanta situationer med tillfredsställande resultat | Komplexa … bekanta situationer … tillfredsställande … | Komplexa … bekanta och nya situationer … gott … |
| Tolka resultat, utvärdera metoder och dra slutsatser av experiment | Eleven ger enkla omdömen samt motiverar sina slutsatser med enkla resonemang | … enkla … välgrundade … | … nyanserade … välgrundade och nyanserade … Vid behov föreslår eleven också förändringar. |
| Språk och kommunikation | Eleven använder med viss säkerhet ett naturvetenskapligt språk och anpassar till viss del sin kommunikation till syfte och sammanhang. | … med viss säkerhet … till stor del … | … med säkerhet … till stor del … |
Vid varje fråga står det vad som bedöms och på vilken nivå du kan besvara frågan.
Språklig bedömning
Jag väger samman all den språkliga bedömning jag gjort på de utredande frågorna, och sätter samman dem till en enda bedömning, som jag för in här, och räknar in i slutpoängen på provet.
För A krävs att beräkningarna är tydligt redovisade med korrekta enheter i varje steg i beräkningen.
Språk och kommunikation (1/1/1)
Hoppa direkt till …
Del I. Frågor som bara kräver ett kort svar (ett ord eller 1–2 meningar)
Längre svar ger risk för avdrag.
- Vilket pH har en 0,01M HCl-lösning vid 25 °C?
Begrepp, modeller, teorier och arbetsmetoder (1/–/–)
- Divätesulfid, H2S, är en svag syra. Teckna uttrycket för syrakonstanten för divätesulfid.
Begrepp, modeller, teorier och arbetsmetoder (1/–/–)
- En kaliumhydroxidlösning, KOH(aq), vid 25 °C har koncentrationen 0,00200 M. Beräkna lösningens pH.
Svara på frågor om och beskriva kemiska företeelser och förlopp (–/1/–)
Del II. Ringa in de rätta svaren
- Vilka tre av följande lösningar har sur reaktion?
Analysera och besvara frågor (1/1/–)
- En lösning där [H+] = [OH–]
- En lösning där [H+] = 2,0·10–7mol/dm3
- En lösning där [H+] = 2[OH–]
- En lösning där [H+] = 3,35 · 10–10mol/dm3
- En lösning där [OH–] = 5,0 · 10–9mol/dm3
- Formeln för vätekarbonatjonens, HCO\(_3^-\), protolys kan skrivas på det här sättet:
HCO\(_3^-\) + H2O ⇌ CO\(_3^{2-}\) + H3O+
Vilka två av nedanstående påståenden om reaktionen är korrekta?Analysera och besvara frågor (1/1/–)
- HCO\(_3^-\) och H3O+ är ett syra–bas-par
- HCO\(_3^-\) och H2O är ett syra–bas-par
- H2O och CO\(_3^{2-}\) fungerar som baser i den här reaktionen.
- H2O är korresponderande bas till H3O+ i den här reaktionen
- HCO\(_3^-\) är korresponderande bas till CO\(_3^{2-}\) i den här reaktionen
Del III. Frågor som kräver ett utredande svar
Skriv svaren på de här frågorna på ett annat papper.
- Oxalsyra, H2C2O4, är en tvåprotonig organisk syra. När den protolyseras bildas väteoxalatjoner, HC2O\(_4^-\)
- Är väteoxalatjonen en amfolyt? Motivera med reaktionsformler.
Begrepp, modeller, teorier och arbetsmetoder (–/1/–)
- Kommer en lösning av natriumväteoxalat att bli sur, neutral eller basisk? Motivera ditt svar med \(\mathrm{p}K\)-värden ur din formelsamling.
Svara på frågor om och beskriva kemiska företeelser och förlopp (–/–/1)
- Är väteoxalatjonen en amfolyt? Motivera med reaktionsformler.
- I ett försök titrerade man 25,0 ml underklorsyrlighet, HClO(aq) med 0,200 M NaOH(aq) och tog upp följande titrerkurva.
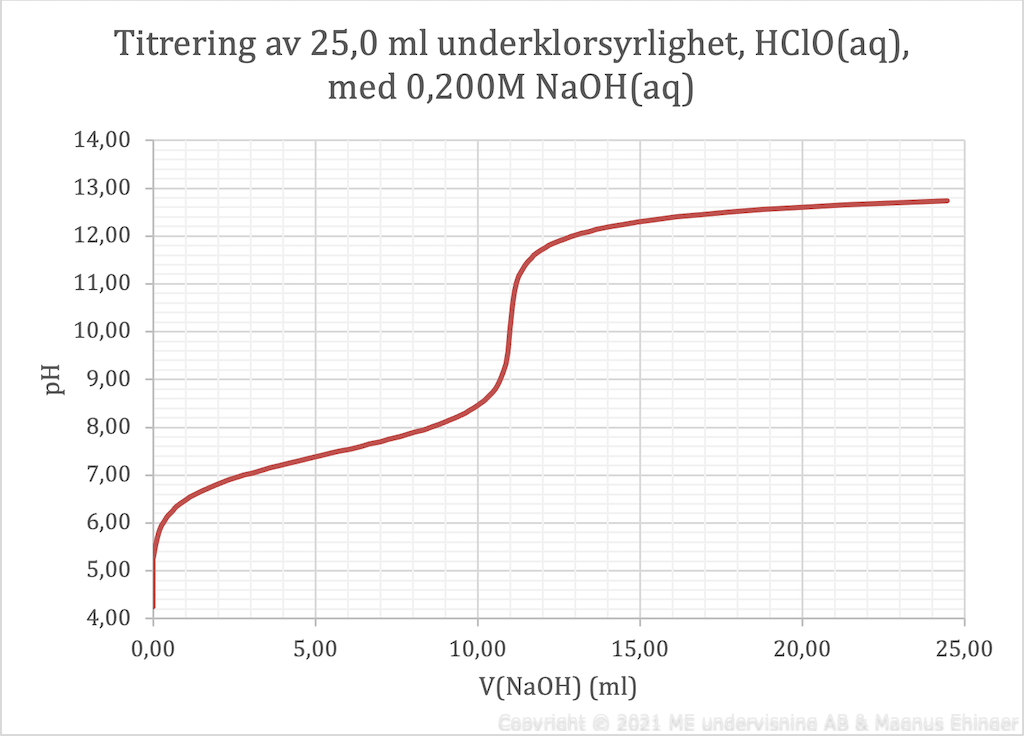
- Hur stor volym natriumhydroxidlösning hade tillsatts vid ekvivalenspunkten? (Endast svar behövs.)
Tolka resultat, utvärdera metoder och dra slutsatser av experiment (1/–/–)
- Beräkna koncentrationen på den ursprungliga underklorsyrligheten.
Tolka resultat, utvärdera metoder och dra slutsatser av experiment (1/1/–)
Språk och kommunikation (S1/S1/S1) - Läs av diagrammet och uppskatta underklorsyrlighetens pKa (den står inte med i formelsamlingen). (Endast svar behövs.)
Tolka resultat, utvärdera metoder och dra slutsatser av experiment (–/1/–)
- Hur stor volym natriumhydroxidlösning hade tillsatts vid ekvivalenspunkten? (Endast svar behövs.)
- I en citratbuffert utnyttjas den buffrande förmågan hos följande jämviktssystem med divätecitratjoner (C6H7O\(_7^-\)) och monovätecitratjoner (C6H6O\(_7^{2-}\)):
C6H7O\(_7^-\) + H2O ⇌ C6H6O\(_7^{2-}\) + H3O+
Förklara med hjälp av reaktionsformler och Le Chateliers princip varför pH inte förändras nämnvärt i en citratbuffert- om man tillsätter en måttlig mängd syra (H3O+) och
- om man till tillsätter en måttlig mängd bas (OH–).
Svara på frågor om och beskriva kemiska företeelser och förlopp (1/1/1)
Språk och kommunikation (S1/S1/S1)
- I ett försök löste man 2,25 g natriumformiat, NaHCOO(s), i vatten till en total volym på 1,00 dm3. Beräkna lösningens pH. För formiatjonen, HCOO–, gäller att \(K_\mathrm{b} = 5,6 \cdot 10^{-11}\mathrm{M}\).
Analysera och besvara frågor (1/1/1)
Språk och kommunikation (S1/S1/S1)
Facit
Betygsgränser
| Max: | 22 | (9/9/4) | |
| Medel: | 17,2 | (7,9/7,2/2,1) – B | |
| E: | 7,0 | ||
| D: | 11,5 | varav | 4,5 A- eller C-poäng |
| C: | 14,5 | varav | 7,0 A- eller C-poäng |
| B: | 16,5 | varav | 2,0 A-poäng |
| A: | 19,5 | varav | 3,0 A-poäng |
Del I. Endast ett kort svar (ett ord eller 1-2 meningar) behövs
- pH = 2
- \[K_{\text{a}} = \frac {[\text{H}^+][\text{HS}^-]}{[\text{H}_2\text{S}]}\hspace{100cm}\] eller \[K_{\text{a}} = \frac {[\text{H}_3\text{O}^+][\text{HS}^-]}{[\text{H}_2\text{S}]}\hspace{100cm}\]
- pH = 11,30
Del II. Ringa in de rätta alternativen!
- b, c, e
- c, d
Del III. Frågor som kräver ett utredande svar (fullständiga beräkningar krävs)
- Ja, eftersom den både kan avge en proton (sur) och ta upp en proton (bas).
Syra: HC2O\({\sf _4^{-}}\)(aq) ⇌ C2O\({\sf _4^{2-}}\)(aq) + H+(aq)
Bas: HC2O\({\sf _4^{-}}\)(aq) + H+ ⇌ H2C2O4
Bedömning
C – Eleven visar med både väteoxalatjonens syrareaktion och basreaktion att väteoxalatjonen är en amfolyt.
- \(\mathrm{p}K_\mathrm{a,\text{ }HC_2O_4^-} = 4,29\) och \(\mathrm{p}K_\mathrm{b,\text{ }HC_2O_4^-} = 12,77\). Eftersom \(\mathrm{p}K_\mathrm{a} < \mathrm{p}K_\mathrm{b}\) är väteoxalatjonen starkare som syra än som bas. Därför kommer lösningen att bli sur.
Bedömning
A – Eleven jämför \(\mathrm{p}K_\mathrm{a}\)- och \(\mathrm{p}K_\mathrm{b}\)-värdena (eller \(K_\mathrm{a}\)- och \(K_\mathrm{b}\)-värdena) med varandra och drar korrekt slutsats ur dem.
- Ja, eftersom den både kan avge en proton (sur) och ta upp en proton (bas).
- 11,1 ml (alla svar 11,0–11,2 är godkända).
-
\[\begin{aligned} n_\mathrm{NaOH} &= c_\mathrm{NaOH} \cdot V_\mathrm{NaOH}= 0,200\mathrm{mol/dm^3} \cdot 0,0111\mathrm{dm^3} = \hspace{100cm} \\ &= 0,00222\mathrm{mol} = n_\mathrm{HClO}\end{aligned}\]
\[c_\mathrm{HClO} = \frac {n_\mathrm{HClO}}{V_\mathrm{HClO}} = \frac {0,00222\mathrm{mol}}{0,0250\mathrm{dm^3}} = 0,0888\mathrm{mol/dm^3} \hspace{100cm}\]
Bedömning
E – Eleven gör en godtagbar ansats till att lösa uppgiften, till exempel genom att beräkna \(n_\mathrm{HCl}\).
C – Eleven löser uppgiften helt korrekt.
Språk och kommunikationE – Eleven använder korrekt storhet och enhet på något ställe i beräkningen.
C – Eleven uppfyller målen för E och använder korrekt någon enhet som inte är given i uppgiften.
A – Eleven använder korrekta storheter och enheter i varje steg av lösningen.
- \(\mathrm{p}K_\mathrm{a} = 7,53\) (alla svar mellan 7,4–7,6 är godkända).
Lösning: Eftersom pKa = pH vid halvtiterpunkten läses kurvan av vid 5,55 ml tillsatt NaOH(aq).
- Le Chateliers princip säger att om ett jämviktssystem rubbas, så sker det en nettoreaktion som motverkar rubbningen. Om vi tillsätter mera syra (H3O+) innebär detta att reaktionen kommer att gå åt vänster tills jämviktsläget åter uppnås, och [H3O+] är ungefär densamma som förut:
C6H7O\(_7^-\) + H2O ← C6H6O\(_7^{2-}\) + H3O+
Om man istället tillsätter en bas (OH–) kommer följande reaktion att ske:
H3O+ + OH– → 2H2O
Det betyder att [H3O+] kommer att sjunka. Återigen gäller Le Chateliers princip, och reaktionen kommer att gå åt höger tills jämvikt åter uppnåtts, och [H3O+] återställts:
C6H7O\(_7^-\) + H2O → C6H6O\(_7^{2-}\) + H3O+
BedömningE – Eleven gör en ansats till att besvara frågan, till exempel genom att definiera Le Chateliers princip eller förklara hur Le Chateliers princip fungerar.
C – Eleven förklarar utförligt vad som händer när syra eller bas sätts till bufferten.
A – Eleven förklarar utförligt och nyanserat vad som när syra och när bas sätts till bufferten.
Kommentar: I förklaringen måste framgå hur [H3O+] påverkas vid och efter tillsatsen syra eller bas.
Språklig bedömningE – Eleven stöttar sin förklaring med någon korrekt skriven, relevant reaktionsformel.
C – Eleven stöttar sin förklaring med två korrekt skrivna, relevanta reaktionsformler.
A – Eleven stöttar sin förklaring med åtminstone tre korrekt skrivna, relevanta reaktionsformler.
- Lösning
HCOO– + H2O ⇌ HCOOH + OH–
\[\begin{align}c_\mathrm{HCOO^-} &= \frac {n_\mathrm{NaHCOO}}{V} = \frac {\frac {m_\mathrm{NaHCOO}}{M_\mathrm{NaHCOO}}}{V} = \frac {\frac {2,25\mathrm{g}}{(23,0+1,01+12,0+16,0\cdot 2)\mathrm{g/mol}}}{1,00\mathrm{dm^3}} = \hspace{100cm} \\ &= 0,03308337\mathrm{mol/dm^3}\end{align}\]
[HCOO–] [HCOOH] [OH–] f.r. \[0,033...\] \[0\] \[0\] M ∆ \[-x\] \[+x\] \[+x\] M v.j. \[0,033...-x\] \[x\] \[x\] M \[K_\mathrm{b} = \frac {[\mathrm{HCOOH}][\mathrm{OH^-}]}{[\mathrm{HCOO^-}]}\hspace{100cm}\]
\[5,6 \cdot 10^{-11} = \frac {x \cdot x}{0,033... - x} \approx \frac {x^2}{0,033...}\hspace{100cm}\]
\[x = \sqrt{5,6 \cdot 10^{-11} \cdot 0,033...} = 0,000001361 = [\mathrm{OH^-}] \hspace{100cm}\]
Eftersom \(x \ll 0,033...\) går det bra att försumma \(x\) bredvid \(0,033...\).
pOH =–lg[OH–] = –lg0,000001361 = 5,866101115
pH = 14,00 – pOH = 14,00 – 5,866101115 = 8,133898885 ≈ 8,13
BedömningE – Eleven gör en godtagbar ansats att lösa frågan, t.ex. genom att beräkna \(c_\mathrm{HCOO^-}\), skriva reaktionsformeln eller teckna baskonstanten för reaktionen.
C – Eleven beräknar \(x\) korrekt, och gör en godtagbar ansats att bestämma vätejonkoncentrationen.
A – Eleven beräknar lösningens pH fullständigt korrekt.