Plocka fram
- Spektrofotometer
Vad är spektrometri?
Materia växelverkar med elektromagnetisk strålning.
- Ljus:
- UV, vis-, IR.
- Magnetfält.
Strålning kan upptas.
Kan också avges, i bestämda energikvanta.
Jämför vad Bohr gjorde med väteatomen! (Fast egentligen var det nog inte han som gjorde det, men han drog vackra slutsatser.)
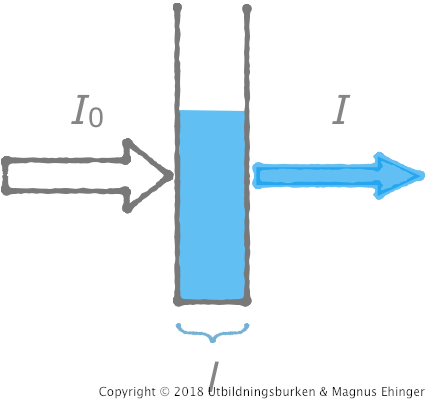
Ljus får passera genom en kyvett med en lösning.
En viss mängd ljus absorberas av lösningen.
Absorbansen \(A\) definieras: .
\[A = \lg\frac {I_0}{I}\]
- \(I_0\) är intensiteten på det ingående ljuset.
- \(I\) är intensiteten på det utgående ljuset.
En del ljus absorberas av kyvetten & lösningsmedlet.
- Man "nollar" först mot en kyvett som endast innehåller lösningsmedlet.
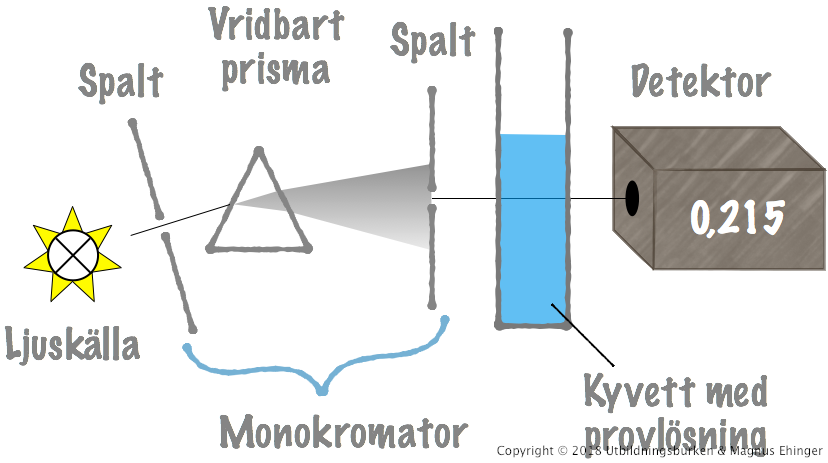
Absorptionsspektrum
Det vridbara prismat gör att man kan mäta absorbansen över hela spektrat på ett prov. I absorptionsspektrat av metylenblått nedan kan man se att det finns ett maximum vid 668 nm. Vill man göra mätningar på metylenblått bör man alltså ställa våglängden på sin spektrofotometer till 668 nm.
Lambert-Beers lag
Tre saker påverkar absorbansen, \(A\):
- Lösningens koncentration, \(c\)
- Ju högre koncentration, desto större absorbans
- Kyvettens längd (eg. bredd), \(l\).
- Ju längre sträcka ljuset måste passera genom lösningen, desto mer ljus absorberas.
- Lösningens inneboende egenskaper (den molara absorptionskoefficienten), \(\epsilon\).
- Lösningar av olika ämnen absorberar olika våglångder, och olika mycket av dem.
Alla tre storheterna kombineras ihop till Lambert-Beers lag:
\[A = c \cdot l \cdot \epsilon\]
Både längden \(l\) och den molara absorptionskoefficienten \(\epsilon\) hålls konstanta om man mäter på ett och samma ämne, och i samma kyvett. Det kan man utnyttja, till exempel i en kalibreringskurva för att mäta koncentrationen i en lösning.
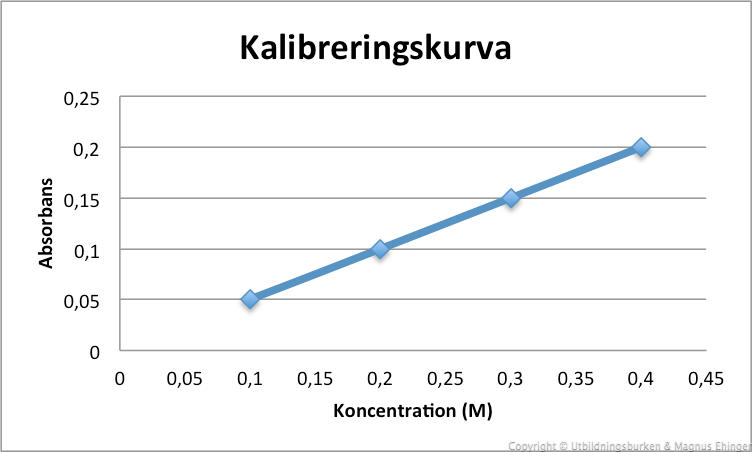
Kalibreringskurva
För att bestämma koncentrationen på en okänd lösning, mäter man först absorbansen på några lösningar där koncentrationen är känd.
- Koncentrationer (M): 0,1; 0,2; 0,3; 0,4
- Absorbansvärden: 0,05; 0,10; 0,15; 0,20
- Sätt in dem i ett diagram: Absorbans på \(y\)-axeln och koncentration på \(x\)-axeln
Okänd lösning: Aborbans: 0,125. Koncentration?
Samma princip kan tillämpas på många olika sätt, exempelvis i AAS och IR-spektrofotometri.