Vad är bindningsentalpi?
Bindningsentalpin = Den energimängd som krävs för att bryta en viss bindning.
Kom ihåg:
- För att bryta bindningar krävs det alltid energi (alltid en endoterm process).
Exempel: Bindningen mellan två väteatomer i en vätemolekyl, H2:
H2(g) → H(g) + H(g) \(\Delta H = +436kJ\)
Förändringen i entalpi ur bindningsentalpierna
Man kan använda bindningsentalpier för att beräkna förändringen i entalpi för en viss reaktion.
\[\Delta H = \sum(\text{BE brutna bindn.}) - \sum (\text{BE bildade bindn.})\]
- OBS: Beräkningen blir alltid felaktig när man använder tabellvärden för bindningsentalpier. Det beror på att tabellvärdena är medelvärden av flera mätningar, och på att samma bindning kan ha olika bindningsentalpi i olika kemiska föreningar.
Titta till exempel på vattenmolekylen,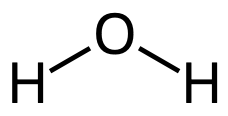 . Den innehåller två bindningar O–H. Den energi som krävs för att bryta den första bindningen O–H är helt annorlunda än den energi som krävs för att bryta den andra bindningen.
. Den innehåller två bindningar O–H. Den energi som krävs för att bryta den första bindningen O–H är helt annorlunda än den energi som krävs för att bryta den andra bindningen.
Exempel
För nedanstående reaktion (addition av vätebromid till eten) har man mätt upp att \(\Delta H = -105,7\mathrm{kJ}\).
C2H4(g) + HBr(g) → C2H5Br(g)
För tydlighetens skull kan vi också skriva reaktionen med strukturformler:
Vi kan (i enlighet med Hess' lag) betrakta reaktionen som att först bryts alla bindningarna mellan atomerna i reaktanterna. Därefter bildas alla de nya bindningarna i produkten.
| Hos reaktanterna bryts … | Bindningsentalpi | Hos produkten bildas … | Bindningstentalpi |
| 4 st. C–H | 414kJ | 5 st. C–H | 414kJ |
| 1 st. C=C | 614kJ | 1 st. C–C | 346kJ |
| 1 st. H–Br | 366kJ | 1 st. C–Br | 285kJ |
\[\begin{aligned}\Delta H &= \sum(\text{BE brutna bindn.}) - \sum (\text{BE bildade bindn.}) = \\ &= \Delta H = (4 \cdot 414 + 614 + 366)\mathrm{kJ} - (5 \cdot 414 + 346 + 285)\mathrm{kJ} = \\ &= -65\mathrm{kJ}\end{aligned}\]
OBS: Det beräknade värdet skiljer sig som sagt avsevärt från det uppmätta.
Bindningsentalpier och bindningars styrka
- Ju mer energi som krävs för att bryta en bindning, desto högre bindningsentalpi.
- Ju mer energi som krävs för att bryta en bindning, desto stabilare ämne.
Exempel
Kvävgas är nästan helt inert:
N≡N \(\Delta H = 945kJ\)
N2(g) + 945kJ → 2N(g)
Jämför med vätgas:
H–H \(\Delta H = 436kJ\)
H2(g) + 436kJ → 2H(g)