Hess' lag
Förändringen av entalpi är oberoende av vilken reaktionsväg man tar – på samma sätt som förändringen av lägesenergi när man bestiger ett berg är oberoende av vilken väg man tar upp till toppen.
 Det spelar ingen roll vilken väg du tar uppför berget – när du når toppen via den orangea vägen har du samma lägesenergi som om du hade tagit den blåa vägen.
Det spelar ingen roll vilken väg du tar uppför berget – när du når toppen via den orangea vägen har du samma lägesenergi som om du hade tagit den blåa vägen.
Exempel: Förbränning av kol i två steg
Steg 1. Vid förbränning av kol i syrefattiga förhållanden bildas kolmonoxid. Då frigörs 111 kJ/mol CO:
- C(s) + ½O2(g) → CO(g) + 111kJ
Bildningsentalpin för CO: \(\Delta H^0_{\text{f, CO}} = -111\text{kJ/mol}\)
Steg 2. Vid förbränning av kolmonoxid bildas koldioxid. Då frigörs 283 kJ/mol CO2:
- CO(g) + ½O2(g) → CO2(g) + 283kJ
Förändringen i entalpi: ΔH = –283kJ/mol
Vi vet att bildningsentalpin för koldioxid är \(\Delta H^0_{\text{f, CO}_2} = -394\text{kJ/mol}\). Om Hess' lag gäller, måste summan av \(\Delta H\)-värdena i steg 1 och 2 vara lika stor som bildningsentalpin för koldioxid.
| Delreaktion 1: | C(s) + ½O2(g) → CO(g) | \(\Delta H = –111\text{kJ}\) |
| Delreaktion 2: | CO(g) + ½O2(g) → CO2(g) | \(\Delta H = –283\text{kJ}\) |
| Totalreaktion: | C(s) + ½O2(g) + CO(g) + ½O2(g) → CO(g) + CO2(g) | |
| Eftersom kolmonoxiden från delreaktion 1 går åt i delreaktion 2 kan vi förenkla nettoreaktionen till följande och summera \(\Delta H\)-värdena: | ||
| Nettoreaktion: | C(s) + O2(g) → CO2(g) | \(\Delta H^0_{\text{f, CO}_2} = -394\text{kJ}\) |
När koldioxid bildas ur kol och syrgas frigörs alltså alltid 394 kJ/mol CO2, oavsett om reaktionen är direkt …
- C(s) + O2(g) → CO2(g)
… eller om den sker i två steg:
- C(s) + ½O2(g) → CO(g)
- CO(g) + ½O2(g) → CO2(g)
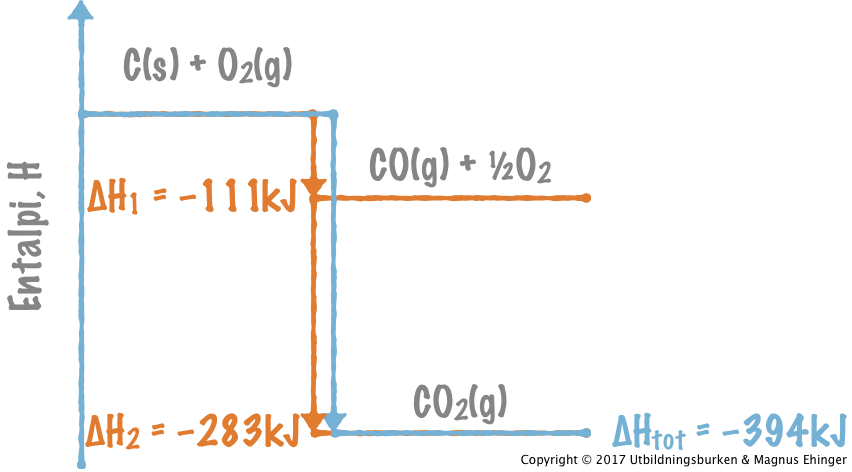 När koldioxid bildas ur kol och syrgas frigörs alltid 394 kJ/mol CO2, oavsett vilken väg reaktionen tar.
När koldioxid bildas ur kol och syrgas frigörs alltid 394 kJ/mol CO2, oavsett vilken väg reaktionen tar.
Exempel
Beräkna \(\Delta H\) för följande reaktion:
2FeO(s) + ½O2(g) → Fe2O3(s)
Vi känner följande:
| 2FeO(s) → 2Fe(s) + O2(g) | \(\Delta H = +556\mathrm{kJ}\) |
| 2Fe(s) +1½O2(g) → Fe2O3(s) | \(\Delta H = -826\mathrm{kJ}\) |
Lösning
Vi tecknar förändringen i entalpi för delreaktionerna:
| Delreaktion 1: | 2FeO(s) → 2Fe(s) + O2(g) | \(\Delta H = +556\mathrm{kJ}\) |
| Delreaktion 2: | 2Fe(s) +1½O2(g) → Fe2O3(s) | \(\Delta H = -826\mathrm{kJ}\) |
| Totalreaktion: | 2FeO(s) + 2Fe(s) + 1½O2(g) → 2Fe(g) + O2(g) + Fe2O3(s) | |
| Eftersom vi har 2Fe både till höger och vänster om reaktionspilen, och vi har 1O2 både till höger och vänster, kan vi stryka dem i nettoreaktionen. | ||
| Nettoreaktion: | 2FeO(s) + ½O2(g) → Fe2O3(s) | \(\Delta H = -270\mathrm{kJ}\) |
Svar: För reaktionen 2FeO(s) + ½O2(g) → Fe2O3(s) är \(\Delta H = -270\mathrm{kJ}\).



